Onvoldoende zelfstandig onderzoek voor aanbesteding van levering van WMO hulpmiddelen
 |
 |
Aanbesteding van WMO hulpmiddelen. Dienstverlening. Deskundige.
De Gemeenten hebben een Europese aanbestedingsprocedure georganiseerd voor de levering van WMO Hulpmiddelen met de bijbehorende dienstverlening. Doel van de aanbesteding is het sluiten van een overeenkomst met één opdrachtnemer die per 1 februari 2013 kan leveren. De Opdracht zal gegund worden aan de voor de Opdrachtgever economisch meest voordelige inschrijving. De inhoudelijke beoordeling van de wensen gebeurt door een multidisciplinair team, waarin de deelnemende gemeenten vertegenwoordigd zijn.
Eiseres stelt dat de winnende inschrijver strategisch en derhalve niet-besteksconform heeft ingeschreven. De aanbestedende dienst en de winnende inschrijver betwisten dat. De voorzieningenrechter is van oordeel dat de aanbestedende dienst vooralsnog onvoldoende zelfstandig onderzoek heeft gedaan om de besteksconformiteit van de door de winnaar ingediende inschrijving te controleren. De aanbestedende dienst wordt – nu zij heeft gemeld dat zij niet over de daarvoor noodzakelijke kennis beschikt – daarom in de gelegenheid gesteld desgewenst om alsnog een deskundige in te schakelen teneinde de besteksconformiteit van de inschrijving van de winnaar te controleren. Zolang vorenbedoeld onderzoek nog niet heeft plaatsgevonden is een definitieve gunning niet mogelijk. Uit het vorenstaande volgt dat de vorderingen van Welzorg op na te melden wijze zullen worden toegewezen en de vorderingen van Meyra zullen worden afgewezen.
4.8. De voorzieningenrechter is thans van oordeel dat de Gemeenten nog niet tot definitieve gunning aan Meyra kunnen overgaan. De Gemeenten dienen – gelet op de klachten van Welzorg – daarvoor eerst te onderzoeken of Meyra op de onderdelen “totaal maandprijs preventief én correctief onderhoud kernassortiment” en “gemiddeld kortingspercentage standaard aanpassingen kernassortiment” kostendekkend heeft ingeschreven. De beoordelingscommissie van de Gemeenten mag deze beoordeling zelf niet meer uitvoeren. Redengevend hiervoor is dat zij niet over de daarvoor benodigde kennis beschikt, zoals door de Gemeenten zelf is verklaard. Voorts is van belang dat de Gemeenten inmiddels te kennen hebben gegeven dat zij tot gunning aan Meyra wil overgaan, waardoor bij beoordeling door dezelfde beoordelingscommissie de indruk van favoritisme zou kunnen ontstaan.
4.9. Het ligt in de gegeven omstandigheden op de weg van de Gemeenten om een externe deskundige in te schakelen. Teneinde de onafhankelijkheid van deze deskundige te waarborgen, dienen de Gemeenten zich vooraf ervan te vergewissen of Meyra dan wel Welzorg bezwaren heeft tegen het inschakelen van de persoon die het onderzoek naar de kostendekkendheid van twee onderdelen van de offerte van Meyra zal uitvoeren. Indien Meyra en Welzorg geen – danwel naar het oordeel van de Gemeenten ongegronde – bezwaren uiten, kunnen de Gemeenten definitief overgaan tot het benoemen van de deskundige.
4.12. Het eindrapport van de deskundige kan naar het oordeel van de voorzieningenrechter slechts twee conclusies bevatten, te weten de aanbieding van Meyra is op de hiervoor bedoelde onderdelen kostendekkend of niet kostendekkend. In geval de deskundige van oordeel is dat de aanbieding van Meyra kostendekkend is, kunnen de Gemeenten in beginsel tot gunning overgaan. Indien de deskundige van oordeel is dat de aanbieding van Meyra niet kostendekkend is, zal de inschrijving van Meyra als ongeldig ter zijde geschoven moeten worden.(...)
Acrylamide opgenomen in de eerste prioriteitenlijst
Gerecht EU 1 februari 2013, zaak T-368/11 (Polyelectrolyte Producers Group, SNF SAS, Travetanche Injection SPRL tegen de Europese Commissie) - dossier
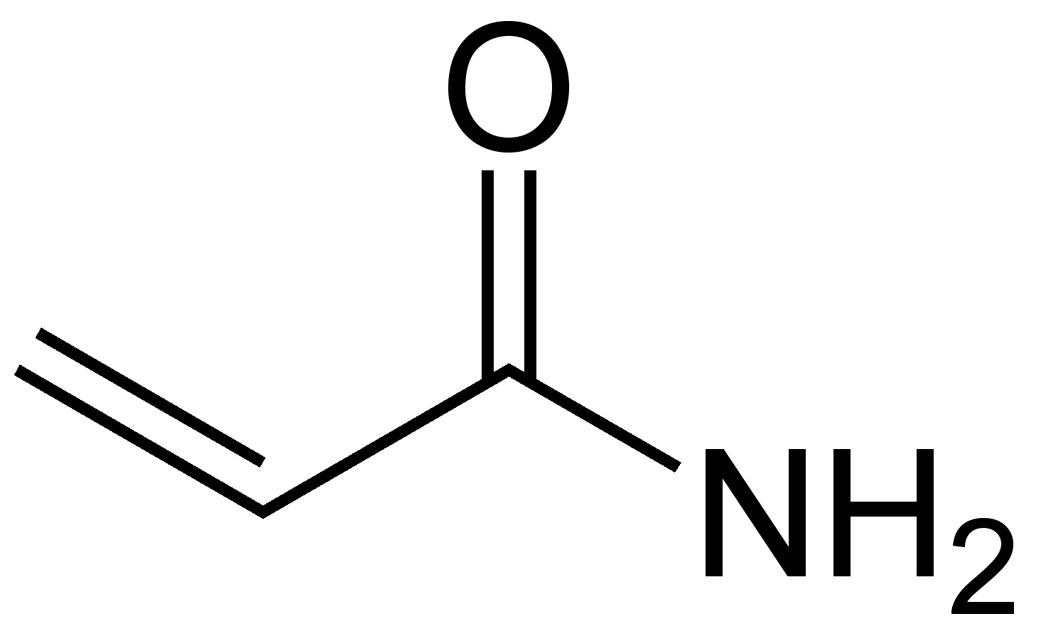 Prioriteitenlijst. Acrylamide. REACH.
Prioriteitenlijst. Acrylamide. REACH.
De eerste eisende partij, Polyelectrolyte Producers Group (PPG) is een Europees economisch samenwerkingsverband, zij vertegenwoordigen bedrijven, Eu-fabrikanten, producenten en importeurs van acrylamide, polyelektrolyten en polyacrylamide. De tweede eiser, SNF SAS, is als bedrijf aangesloten bij het samenwerkingsverband van PPG. De derde kandidaat, Travetanche Injection SPRL, een leverancier van acrylamide diensten op bouwplaatsen. De stof, acrylamide, wordt gebruikt bij de productie van polyacrylamide, die wordt ingezet in de bouwsector bij de reparatie van metselwerk en beton tegen het doorlaten van water. De Commissie heeft Aacrylamide opgenomen in de eerste prioriteitenlijst, een lijst van prioritaire stoffen of groepen van stoffen die bijzondere aandacht behoeven wegens hun mogelijke effecten op de mens of het milieu.
Eisende partijen voeren drie middelen aan tot staving van het optreden. Het eerste heeft betrekking op een kennelijke beoordelingsfout met betrekking tot de risico-evaluatie. Het tweede middel betreft de schending van het evenredigheidsbeginsel. Het derde middel heeft betrekking op de schending van de motiveringsplicht.
Het eerste middel: kennelijke beoordelingsfout bij de evaluatie van de risico's
Er zijn geen redenen om te concluderen dat de Commissie een kennelijke beoordelingsfout heeft gemaakt. Gebaseerd op de beoordeling van de risico's met betrekking tot blootstelling aan acrylamide bij grootschalige toepassing van op NMA gebaseerde voegmiddelen. Aangezien op NMA gebaseerde middelen ook acrylamide bevatten en NMA in deze producten wordt omgezet in acrylamide, heeft dit als gevolg dat het acrylamide gehalte in de uiteindelijke hars nog 1% is na drie uur vermengen, kan de mens en het milieu tijdens grootschalige toepassingen worden blootgesteld aan acrylamide.
Tweede middel: schending van het evenredigheidsbeginsel
De Commissie beschikt over een ruime beoordelingsvrijheid bij politieke, economische en sociale keuzes. De rechtmatigheid van een maatregel op dit gebied kan slechts worden afgedaan, wanneer de maatregel kennelijk ongeschikt is gelet op het door de wetgever nagestreefde doel. De doelstelling van de verordening is de bescherming van de menselijke gezondheid en het milieu. De Commissie verwijst naar het EU-risicobeoordeling rapport en de Aanbeveling 2004/394, die rekening houdt met het advies van het Wetenschappelijk Comité voor de toxiciteit, de ecotoxiciteit en Milieubeheer. In het rapport is de risicobeoordeling en de risicobeperkingsstrategie voor acrylamide door de Commissie aangenomen. De Commissie heeft bepaald dat deze risico's niet zijn beperkt tot de risico's voor werknemers en consumenten, voor wie de noodzakelijke risicobeperkende maatregelen reeds zijn getroffen of voor wie het bestaande wettelijk kader voldoende wordt geacht.
Derde middel: schending van de motiveringsplicht
Gelet op deze overwegingen en de procedurele context waarin de bestreden verordening is opgesteld blijkt dat de Commissie geen inbreuk heeft gemaakt op zijn motiveringsplicht. Ook het derde middel wordt verworpen en daarmee het gehele beroep afgewezen.
69. In view of those considerations, there are no grounds for concluding that the Commission made a manifest error of assessment in basing its evaluation of the risks concerning exposure to acrylamide in large-scale grouting applications on data relating to NMA-based grouts. Indeed, given that NMA-based grouts also contain acrylamide and given that NMA in those products may be transformed into acrylamide, with the result that the acrylamide content in the final resin is still 1% three hours after the solutions concerned have been mixed with water and polymerisation has begun, humans and the environment are exposed to acrylamide during large-scale grouting applications.
76. With regard to judicial review of the conditions referred to in the previous paragraph, the Commission must be allowed a broad discretion in a sphere which entails political, economic and social choices on its part and in which it is called upon to undertake complex assessments. The legality of a measure adopted in that sphere can be affected only if the measure is manifestly inappropriate having regard to the objective which the legislature is seeking to pursue (see Etimine, paragraph 29 above, paragraph 125 and the case-law cited).
104. Having regard to those considerations and to the procedural context in which the contested regulation was prepared, with which the applicants were familiar as is apparent from the application and the annexes thereto, the Commission did not infringe its obligation to state reasons.
NMa concentratie topklinische zorg toegestaan
NMa besluit, 21 januari 2013, nummer 7545 / 78 (HagaZiekenhuis - Reinier de Graaf Groep)
 |
 |
Voorgenomen concentratie in de zin van artikel 34 van de Mededingingswet. De activiteiten van partijen overlappen zowel op het gebied van algemene ziekenhuiszorg als topzorg. Wat betreft topzorg overlappen de activiteiten van partijen alleen op het gebied van radiotherapie.
Op basis van de analyse van de patiëntenstromen, de reistijdenanalyse, het kwalitatieve onderzoek en de uitstroompercentages is het niet aannemelijk dat partijen als gevolg van de concentratie in staat zouden zijn om winstgevend een significante prijsverhoging en/of kwaliteitsdaling door te voeren op de locaties van Haga of RdGG (overweging 69-71).
Gelet op de aanwezigheid van andere ziekenhuizen, de concurrentiedruk die andere ziekenhuizen op partijen uitoefenen en het beperkte voorspelde prijseffect dat uit de modellen komt, acht de NMa het in het licht van alle uitgevoerde analyses niet aannemelijk dat de mededinging als gevolg van de voorgenomen concentratie significant zou kunnen worden belemmerd. Concentratie is toegestaan er is geen vergunning vereist.
Topklinische en topreferente zorg
17. In eerdere besluiten van de NMa is op grond van overwegingen met betrekking tot vraag- en aanbodsubstitutie en verschillen in toetredingsdrempels uitgegaan van het bestaan van aparte productmarkten voor topzorg (waaronder topklinische en topreferente zorg) en algemene (niet-hoogspecialistische) ziekenhuiszorg. Behandelingen waarvoor
een vergunning is vereist op basis van de Wet op bijzondere medische verrichtingen (hierna: WBMV) worden in ieder geval gerekend tot de topklinische ziekenhuiszorg en worden als afzonderlijke productmarkten binnen de (topklinische) ziekenhuiszorg aangemerkt.
19. Om te onderzoeken of er mogelijk sprake is van marktuitsluitende effecten heeft de NMa de andere ziekenhuizen en zorgverzekeraars hierover bevraagd. Geen van deze ziekenhuizen heeft desgevraagd aangegeven afhankelijk te zijn van de doorverwijzing van patiënten op het gebied van topklinische en/of topreferente zorg vanuit partijen. Ook de zorgverzekeraars voorzien op dit gebied geen nadelige effecten van de voorgenomen concentratie. Het is derhalve niet aannemelijk dat als gevolg van de concentratie tussen partijen andere ziekenhuizen zullen worden uitgesloten van de markten voor topklinische en of topreferente zorg.
Kamerantwoorden: Belangrijkste alarmsymptomen in de bijsluiter
Antwoorden op kamervragen van het Kamerlid Van Gerven (SP) over het bericht dat het CBG is gezwicht om een vaginaal antischimmelmiddel op de vrije markt te brengen, Kamerstukken II 2012/13, 2012Z22976.
.gif)
 Door de beslissing van het CBG is dit antischimmelmiddel verkrijgbaar bij apotheek en drogist (afgekort UAD). Het artikel meldt dat niet alle bekende “alarmsymptomen” in de bijsluiter van deze antischimmelmiddelen zouden staan. Dit is volgens het CBG niet het geval; de bijsluiter bevat alle alarmsymptomen omdat dit bij uitstek nuttig is om vrouwen aan te sporen alsnog hun huisarts te raadplegen. Daarnaast wordt volgens het CBG in het artikel de dosering van deze geneesmiddelen, als een van de bepalende factoren voor de behandelduur, onvoldoende benadrukt.
Door de beslissing van het CBG is dit antischimmelmiddel verkrijgbaar bij apotheek en drogist (afgekort UAD). Het artikel meldt dat niet alle bekende “alarmsymptomen” in de bijsluiter van deze antischimmelmiddelen zouden staan. Dit is volgens het CBG niet het geval; de bijsluiter bevat alle alarmsymptomen omdat dit bij uitstek nuttig is om vrouwen aan te sporen alsnog hun huisarts te raadplegen. Daarnaast wordt volgens het CBG in het artikel de dosering van deze geneesmiddelen, als een van de bepalende factoren voor de behandelduur, onvoldoende benadrukt.
2 Welke studie(s) lag(en) ten grondslag aan het besluit in 2010 van het College ter Beoordeling van Geneesmiddelen (CBG) om de uitsluitend-recept-status te handhaven?
3 Welke studie lag ten grondslag aan het besluit van het CBG om de afleverstatus te wijzigen naar uitsluitend-Apotheek- en Drogist (UAD), zoals beschreven in het artikel?
Nadat het CBG in 2010 de UR-status had vastgesteld vanwege verkeerde zelfdiagnose, bleek uit onderzoek dat het stellen van een verkeerde zelfdiagnose bij de eerste symptomen - en daarmee een vertraging in het verkrijgen van de juiste behandeling – hoe dan ook voorkomt, of het geneesmiddel nu wel of niet UR is.
Ook bleek dat de risico’s op complicaties niet vergroot worden door de UAD-afleverstatus van Canesten gyno. (...)
Daarnaast bleek uit onderzoek van Becker en Gessner dat er bij vrouwen terughoudendheid bestaat om advies te vragen aan een arts bij het optreden van symptomen van vaginale infectie. De studie liet zien dat vrouwen gemiddeld vijf dagen wachtten, voordat zij contact opnamen met een arts. In deze tijd werden verschillende andere middelen uitgeprobeerd. Het verdient dan volgens het CBG de voorkeur om in de periode vóór raadpleging van een arts, gebruik te maken van een geregistreerd zelfzorggeneesmiddel met deze indicatie, ten opzichte van niet geregistreerde middelen.
Het CBG heeft vervolgens op basis hiervan in 2011 de afleverstatus van antischimmelmiddelen gewijzigd van UR naar UAD. In de overweging nam het CBG mee dat in de bijsluiter duidelijk wordt gewaarschuwd de huisarts te raadplegen wanneer de klachten niet overgaan.
5. Waarom verplichtte het CBG de fabrikant alleen de belangrijkste alarmsymptomen op te nemen in de bijsluiter? Om welke alarmsymptomen gaat het? Welke (alarm)symptomen zijn niet opgenomen in de bijsluiter, en waarom niet?
5 Het CBG heeft de firma verplicht alle alarmsymptomen op te nemen in de bijsluiter. Deze bijsluiter maakt duidelijk in welke situaties er contact opgenomen moet worden met de huisarts: door meisjes jonger dan 16 jaar, door zwangere vrouwen, door vrouwen met een verhoogd risico op een seksueel overdraagbare aandoening, bij lichamelijke klachten die duiden op een ernstige aandoening (sterk ruikende afscheiding, koorts of koude rillingen, rugpijn, buikpijn, onregelmatige of abnormale bloedingen, zweren of blaren in het genitale gebied, misselijkheid of braken, diarree, pus), wanneer klachten vaker dan drie keer in het afgelopen jaar zijn waargenomen, of indien de symptomen verergeren dan wel zeven dagen na start van de behandeling aanblijven. Ook wordt er aangegeven dat het mogelijk is dat bij terugkerende klachten dat candida via een partner wordt overgedragen, en in dat geval de partner moet worden behandeld.
6. Acht u het opnemen van de belangrijkste alarmsymptomen in de bijsluiter een voldoende waarborg om vrouwen te waarschuwen voor mogelijke risico's?
6 Het CBG is van oordeel dat de informatie in de bijsluiter een voldoende waarborg is voor veilig gebruik. Het is echter ook de verantwoordelijkheid van vrouwen die dit middel gebruiken, om de bijsluiter goed te lezen en de instructies op te volgen.
10 Hoe worden de gevolgen van het vrijgeven van de vaginale antischimmelmiddelen gemonitord? Hoe wordt de Kamer hiervan op de hoogte gesteld?
10 Het CBG is belast met geneesmiddelenbewaking. Voor alle in Nederland geregistreerde geneesmiddelen, en dus ook antischimmelmiddelen, verzamelt en beheert het CBG systematisch gegevens over bijwerkingen en het gebruik en misbruik. Deze gegevens zijn onder meer afkomstig van houders van handelsvergunningen, van de stichting Lareb, van spontane meldingen (wereldwijd) en van alle relevante gepubliceerde studies uit de wetenschappelijke literatuur. Het CBG kan nieuwe besluiten nemen, bijvoorbeeld over de verkrijgbaarheid, indien de gegevens uit de geneesmiddelenbewaking van vaginale antischimmelmiddelen daartoe aanleiding geven.
Toespelingen op medische claims
Vz RCC 18 januari 2013, dossiernr. 2012/01071 (Spiruella)
 Het betreft een uiting op www.spiruella.nl voor “Bio Chlorella Pyrenoidosa tabletten (500gr)”. Daarin staat onder het kopje “Mogelijke voordelen Chlorella” onder meer: “helpt kanker voorkomen en bij de groei van tumoren”; “helpt de bloeddruk normaliseren” en “stabiliseert de bloedsuikerspiegel”.
Het betreft een uiting op www.spiruella.nl voor “Bio Chlorella Pyrenoidosa tabletten (500gr)”. Daarin staat onder het kopje “Mogelijke voordelen Chlorella” onder meer: “helpt kanker voorkomen en bij de groei van tumoren”; “helpt de bloeddruk normaliseren” en “stabiliseert de bloedsuikerspiegel”.
Indien de uiting aan de KAG was voorgelegd, zou deze niet van een toelatingsnummer zijn voorzien. Er is sprake van strijd met de Code Aanprijzing Gezondheidsproducten en met de Warenwet, omdat de uiting (toespelingen op) medische claims c.q geneeskundige aanprijzingen bevat. De uiting is aangepast met een disclaimer.
De voorzitter is van oordeel dat de klacht de Commissie aanleiding zal geven een aanbeveling te doen. De adverteerder gebruikt diverse (toespelingen op) medische claims voor haar product. Nu aan dit middel eigenschappen worden toegeschreven inzake het voorkomen, behandelen of genezen van een ziekte van de mens, dan wel toespelingen op zodanige eigenschappen worden gemaakt, is er sprake van verboden claims in de zin van artikel 20 lid 2 onder a van de Warenwet. Er volgt een aanbeveling, de uiting is in strijd met artikel 2 en 7 NRC.
Adverteerder gebruikt in de bestreden uiting diverse (toespelingen op) medische claims voor haar product, zoals bijvoorbeeld “vermindert astma en allergie symptomen”, “vermindert de bloeddruk en het cholesterolgehalte”, “helpt bij het voorkomen van hart- en vaatziekten” en “sterke ontstekingsremmende effecten”.
“Bio Chlorella Pyrenoidosa tabletten” kunnen worden aangemerkt als een voor orale nuttiging door de mens bestemd middel. Het product valt derhalve onder de werking van artikel 20 lid 2 sub a van de Warenwet. Nu aan dit middel eigenschappen worden toegeschreven inzake het voorkomen, behandelen of genezen van een ziekte van de mens, dan wel toespelingen op zodanige eigenschappen worden gemaakt, is er sprake van verboden claims in de zin van artikel 20 lid 2 onder a van de Warenwet. Gelet hierop is de uiting in strijd met artikel 2 van de Nederlandse Reclame Code (NRC).
Aan dit oordeel doet niet af dat de bewuste medische claims onder het kopje: “Mogelijke voordelen Chlorella” staan.
Nu adverteerder voorts niet heeft aangetoond dat “Bio Chlorella Pyrenoidosa tabletten” helpen bij de in de uitingen opgenomen aandoeningen, gaat de reclame gepaard met onjuiste informatie ten aanzien van de van het gebruik van het product te verwachten resultaten als bedoeld in artikel 8.2 aanhef en onder b NRC. Nu de uiting de gemiddelde consument er bovendien toe kan brengen een besluit over een transactie te nemen, dat hij anders niet had genomen, is de uiting misleidend en daardoor oneerlijk als bedoeld in artikel 7 NRC.
Kamerantwoorden: alternatieve behandeling chelatietherapie
Antwoord op vragen van het lid Bouwmeester over de gezondheidsrisico's van de alternatieve behandeling chelatietherapie, Aanhangse Handelingen II 2012/13, nr. 1079.
.gif)
 1 Kunt u een reactie geven op de TV-uitzending over de alternatieve behandeling chelatietherapie die volgens een advies van de Gezondheidsraad ‘niet aanvaardbaar’ is en zelfs de dood tot gevolg kan hebben? 1)
1 Kunt u een reactie geven op de TV-uitzending over de alternatieve behandeling chelatietherapie die volgens een advies van de Gezondheidsraad ‘niet aanvaardbaar’ is en zelfs de dood tot gevolg kan hebben? 1)
1. De uitzending sprak denk ik voor zichzelf. Ik vind het ernstig te betreuren dat artsen behandelingen aanbieden waarvan bekend is dat ze niet werken. Dat geldt des te meer als die behandelingen ingrijpende onbedoelde effecten
kunnen hebben.
(...)
2 Er is geen bewijs voor de medische werkzaamheid van chelatietherapie gebaseerd op wetenschappelijk onderzoek anders dan voor het behandelen van metaalvergiftigingen. Evenals de Inspectie voor de gezondheidszorg (IGZ) beschouw ik chelatietherapie bij behandeling van hart- en vaatziekten als een alternatieve behandeling met een niet geregistreerd, in de apotheek bereid geneesmiddel. Wanneer gekwalificeerde (individuele) beroepsbeoefenaren de betreffende behandeling aanbieden en toepassen dan nemen zij daarmee de verantwoordelijkheid voor de mogelijk negatieve effecten daarvan op zich.
De behandeling wordt in privéklinieken slechts op zeer beperkte schaal toepast.
4 Is het waar dat de Inspectie voor de Gezondheidszorg (IGZ) pas in algemene zin kan optreden tegen chelatietherapeuten als de therapie voor hart- en vaatziekten verboden is?
4 De IGZ kan handhavend optreden als zij van oordeel is dat de kwaliteit van zorg aantoonbaar onvoldoende is en/of patiëntveiligheid aantoonbaar in gevaar is en/of de wijze waarop het product is bereid kwalitatief onvoldoende is. Zij kan, op basis van de Kwaliteitswet zorginstellingen en de Wet BIG, een bevel uitvaardigen om de behandelaar(s) te dwingen om te stoppen met de therapie of een tuchtprocedure starten tegen de betreffende beroepsbeoefenaar. Tevens kan zij op basis van de Geneesmiddelenwet stappen ondernemen wanneer het voor deze therapie benodigde natriumedetaat onder ongeoorloofde omstandigheden wordt bereid en afgeleverd. Alleen het enkele feit dat een alternatieve behandeling onwerkzaam is, zoals chelatietherapie bij hartvaatziekte, is als zodanig inderdaad geen aanleiding voor handhavend optreden door IGZ. Bij het aanbieden van alternatieve therapieën moet helder worden aangegeven dat het geen reguliere zorg betreft en moet de patiënt worden voorgelicht over de risico’s. Ook moet de patiënt worden doorverwezen naar de reguliere gezondheidszorg als daarvoor aanleiding is.
8 Hoeveel tuchtzaken zijn u sinds 1983 bekend waar chelatietherapeuten bij betrokken waren?8 In relatie tot chelatietherapie zijn mij twee uitspraken bekend, te weten de uitspraak van 7 juni 2011 van het Regionaal Tuchtcollege (RTC) Eindhoven (ref. Y61152) en de uitspraak van 21 juni 2012 van het Centraal Tuchtcollege
voor de gezondheidszorg (CTC), Den Haag (ref. Y62148). Het gaat hier om twee uitspraken betreffende één en dezelfde zaak. De tuchtrechter verwijt de arts dat deze tekort is geschoten in zijn zorgplicht, omdat hij een patiënt die in
mogelijk levensgevaar verkeerde niet nadrukkelijk genoeg heeft doorverwezen naar de reguliere gezondheidszorg voor een therapie die hij dringend nodig had op dat moment.
Een LinkedIn-profiel is een persoonlijk profiel
Rechtbank Oost-Nederland, locatie Almelo 22 januari 2013, LJN BZ0324 (Privatescan B.V. tegen Prescan B.V.)
 Executievonnis. LinkedIn-profiel is persoonlijke profiel. Door maatman-consument te googelen profielpagina. Overtreding verbod van ondergeschikte aard. Verbod op executie van dwansommen en opheffing executoriaal (derden)beslag.
Executievonnis. LinkedIn-profiel is persoonlijke profiel. Door maatman-consument te googelen profielpagina. Overtreding verbod van ondergeschikte aard. Verbod op executie van dwansommen en opheffing executoriaal (derden)beslag.
In het eindvonnis (IEF 11704) is onder meer bevolen om de mededeling ‘Privatescan is marktleider’ te staken en gestaakt te houden, onder last van een dwangsom. In elk geval van 25 oktober 2012 tot en met 19 november 2012 stond er op het LinkedIn-profiel van eiser sub 1: ‘Privatescan is marktleider’.
De voorzieningenrechter is van oordeel dat het LinkedIn profiel een persoonlijk profiel van eiser is, omdat allereerst de naam en foto van zijn gezicht is opgenomen. De maatman-consument zal niet worden beïnvloed door een mededeling op een LinkedIn-profiel. Het LinkedIn-profiel is te benaderen door 'Privatescan' te googelen en dus is het vonnis overtreden. Het is veel waarschijnlijker dat de maatman-consument op andere sites zal kijken, indien hij informatie over Privatescan dan wel Prescan zoekt, dan dat hij op het persoonlijke LinkedIn profiel van de directeur van Privatescan kijkt. De voorzieningenrechter is in dit geval van oordeel dat de overtreding van ondergeschikte aard is, waardoor geen dwangsommen zijn verbeurd.
De voorzieningenrechter verbiedt Prescan de executie van de dwangsommen op basis van het vonnis te staken en gestaakt te houden voor zover deze executie van de dwangsommen betrekking heeft op de zin ‘Privatescan is marktleider’, zoals deze is geplaatst op LinkedIn vanaf de betekening van het bestreden vonnis tot het moment dat deze zin van LinkedIn is verwijderd en heft de gelegde executoriale (derden)beslagen en executoriale aandelenbeslagen op.
4.3. De voorzieningenrechter is van oordeel dat het LinkedIn profiel een persoonlijk profiel van [eiser sub 1] is en overweegt daartoe als volgt. Bovenaan het LinkedIn profiel is allereerst de naam van [eiser sub 1] opgenomen, met daarnaast een foto van zijn gezicht. Onder de naam van [eiser sub 1] staat vermeld dat hij ‘owner’ van Privatescan is. LinkedIn is een online sociaal netwerk dat de deelnemers in de gelegenheid stelt gebruik te maken van elkaars zakelijke netwerk. Het idee achter LinkedIn is juist dat het persoonlijk profiel wordt gebruikt voor zakelijke en carrièregerichte doeleinden. Dat het LinkedIn profiel van [eiser sub 1] kennelijk voornamelijk wordt gebruikt voor zakelijke doeleinden met betrekking tot zijn bedrijf Privatescan (zoals diverse polls en een beschrijving van Privatescan), maakt niet dat dit profiel daardoor van Privatescan is. LinkedIn biedt namelijk aan bedrijven de mogelijkheid om een eigen zakelijk profiel aan te maken. Ook Privatescan heeft zo’n zakelijk profiel, zo blijkt uit productie 9 bij de conclusie van antwoord. Dat een aantal medewerkers van Privatescan toegang heeft tot het profiel van [eiser sub 1] en het account betaald wordt door Privatescan, doet aan het voorgaande niet af. Het is het persoonlijke profiel van [eiser sub 1], dat hij gebruikt voor zakelijke doeleinden door onder meer Privatescan te promoten.
4.9. [Eiser sub 1 c.s.] heeft aangevoerd dat de maatman-consument niet zal worden beïnvloed door een mededeling op een LinkedIn profiel, omdat een LinkedIn profiel, anders dan veel andere websites, niet voor het informeren van consumenten wordt gebruikt. Bovendien voert [eiser sub 1 c.s.] aan dat bij LinkedIn eerst door de gebruiker van een profiel eerst toegang tot dat profiel moet zijn verleend, voordat de consument toegang heeft tot informatie op dat profiel. Prescan heeft de stellingen van [eiser sub 1 c.s.] weersproken.
4.10. De voorzieningenrechter overweegt als volgt. Een LinkedIn profiel kan ook bezocht worden door personen die niet in het bezit zijn van een eigen LinkedIn profiel of die niet ingelogd zijn op hun profiel, afhankelijk van de instellingen van het LinkedIn profiel wat zij willen bekijken. De instellingen van het LinkedIn profiel van [eiser sub 1] waren ten tijde van de zitting dusdanig, dat het profiel ook voor mensen zonder LinkedIn profiel toegankelijk was, bijvoorbeeld via google. Dat betekent dat ook de ‘maatman-consument’ op het profiel van [eiser sub 1] terecht kon komen, bijvoorbeeld door ‘Privatescan’ te googelen. Zo bezien heeft [eiser sub 1] het vonnis van de rechtbank ’s-Gravenhage dus overtreden. De vraag die de voorzieningenrechter echter dient te beantwoorden is of deze overtreding, met inachtneming van de eisen van redelijkheid en billijkheid, voldoende ernstig is om te rechtvaardigen dat daardoor dwangsommen zijn verbeurd.
4.12. De voorzieningenrechter is in dit geval van oordeel dat de overtreding van ondergeschikte aard is, waardoor geen dwangsommen zijn verbeurd en heeft daarbij het volgende in aanmerking genomen. De rechtbank ‘s-Gravenhage heeft de veroordeling uitgesproken naar aanleiding van artikelen die te vinden waren op de De Standaard Online (een Belgische website) en op Medical Facts (een Nederlandse website), waarin stond vermeldt dat Privatescan marktleider was. Het is veel waarschijnlijker dat de maatman-consument op dergelijke sites zal kijken, indien hij informatie over Privatescan dan wel Prescan zoekt, dan dat hij op het persoonlijke LinkedIn profiel van de directeur van Privatescan kijkt. De maatman-consument zal op zoek gaan naar reviews van andere consumenten, (nieuws)artikelen of vergelijkingen van Privatescan en Prescan. [Eiser sub 1] heeft bovendien – onbetwist – aangevoerd dat er sinds het vonnis van de rechtbank ’s-Gravenhage (vrijwel) geen consumenten op zijn LinkedIn profiel hebben gekeken, maar dat het profiel voornamelijk is bezocht door Prescan en door de deurwaarder die door Prescan is ingeschakeld. Nadat Prescan [eiser sub 1 c.s.] op de hoogte stelde van de zinsnede op het LinkedIn profiel, heeft [eiser sub 1 c.s]. de zinsnede bovendien direct verwijderd.
4.13. Hoewel het plaatsen van de zinsnede ‘Privatescan is marktleider’ dus valt binnen het doel van de veroordeling in het vonnis van de rechtbank ’s-Gravenhage, is de overtreding van zodanige ondergeschikte betekenis dat naar het oordeel van de voorzieningenrechter door de overtreding geen dwangsommen zijn verbeurd.
Geen openheid van zaken leidt niet tot onherstelbaar beschadigd vertrouwen
Ktr. Almelo, Rechtbank Oost-Nederland 29 januari 2013, LJN BY9847 (eiser tegen Stichting Livio) Contract. Basisarts. Openheid van zaken. CV. Eiser is als basisarts in dients van Livio, het contract is via het bemiddelingsbureau Start tot stand gekomen. In het Curriculum Vitae blijkt dat over de periode 2003 – 2011 een gat bestaat in werkervaring van acht jaar. Start heeft het CV aan Livio verstrekt. Bij het aangaan van het dienstverband zijn partijen overeengekomen dat eiser de opleiding tot Specialist Ouderen Geneeskunde zou gaan volgen met ondersteuning van Livio.
Contract. Basisarts. Openheid van zaken. CV. Eiser is als basisarts in dients van Livio, het contract is via het bemiddelingsbureau Start tot stand gekomen. In het Curriculum Vitae blijkt dat over de periode 2003 – 2011 een gat bestaat in werkervaring van acht jaar. Start heeft het CV aan Livio verstrekt. Bij het aangaan van het dienstverband zijn partijen overeengekomen dat eiser de opleiding tot Specialist Ouderen Geneeskunde zou gaan volgen met ondersteuning van Livio.
Livio is benaderd door de Hoofdinspectie der Volksgezondheid. De vraag werd voorgelegd of zij ervan op de hoogte was dat één van haar artsen een crimineel verleden had. Livio heeft die vraag ontkennend beantwoord. Een gesprek tussen eiser en Livio heeft plaatsgevonden waarin eiser heeft erkend in detentie te hebben gezeten, wegens het in brand laten steken van zijn vrouw. Bij brief heeft Livio aangegeven dat eiser bij zijn aanstelling openheid van zaken had moeten geven. Door onjuiste informatie te verschaffen over het gat in zijn CV heeft hij zowel Start als Livio op het verkeerde been gezet. Als gevolg hiervan is het vertrouwen van Livio ernstig geschonden. [eiser] is hierop vrijgesteld van het verrichten van werkzaamheden met behoud van salaris. Tevens werd hem meegedeeld dat de met hem gesloten arbeidsovereenkomst per 1 maart 2013 van rechtswege zou eindigen.
Naar het oordeel van de kantonrechter rustte op eiser onder die omstandigheden niet de plicht om uit zichzelf opening van zaken te geven omtrent zijn verleden. Dat het vertrouwen een deuk heeft opgelopen, wil de kantonrechter wel geloven, maar dat deze onherstelbaar is, lijkt wat overtrokken. Livio dienst de hand ook in eigen boezem te steken naar het oordeel van de rechtbank. Indien zij op een alerte wijze het sollicitatiegesprek was ingegaan en in dat gesprek de gebruikelijke vragen had gesteld, dan had zij het hele verhaal boven tafel gekregen. Dit heeft zij niet gedaan, zodat het niet fair lijkt om de gevolgen van haar eigen onjuist handelen geheel en al voor rekening van eiser te laten komen.
De rechtbank veroordeelt Livio om eiser binnen één week na betekening van het vonnis toe te laten tot het verrichten van de bedongen werkzaamheden als verpleeghuisarts/specialist Ouderenzorg in opleiding en hem alle ondersteuning te bieden bij het effectueren en volgen van de opleiding tot Specialist Ouderen Zorg, waaronder begrepen maar daartoe niet beperkt, het bieden van de voor die opleiding vereiste stageplaatsen en noodzakelijke begeleiding.
Het verweer: (...)
Naar het oordeel van de kantonrechter rustte op [eiser] onder die omstandigheden niet de plicht om uit zichzelf opening van zaken te geven omtrent zijn verleden. Livio betoogt weliswaar anders maar daarbij miskent zij dat er voor [eiser] geen reden aanwezig was om er van uit te gaan dat zijn spreken noodzakelijk was voor een goede uitoefening van de werkzaamheden: het gebeuren heeft zich immers afgespeeld in de relationele sfeer, terwijl die situatie zich naar alle waarschijnlijkheid niet meer voor zal gaan doen, zodat het verleden niet relevant is voor een goede uitoefening van de werkzaamheden. (...)
Uit voorgaande vloeit voort dat de kantonrechter de vordering in kort geding als na te melden zal toewijzen. De vraag of er sprake is van een al dan niet verlengde arbeidsovereenkomst kan daarbij voorshands buiten beschouwing blijven, omdat het in deze gaat om de beweerde overeenkomst die er toe zou leiden dat [eiser] zal worden toegelaten tot de opleiding tot specialist Ouderengeneeskunde. Het moge dan zo zijn dat er wellicht (nog) geen op schrift gestelde overeenkomst met betrekking tot de stageplaats bij Livio is opgesteld, feit is wel dat beide partijen op zijn zachtst gezegd de intentie hadden om [eiser] in staat te stellen die opleiding te gaan volgen en dat Livio daarvoor een stageplaats zou leveren. Dit nu is de strekking van de vordering van [eiser] en die is naar de vaste overtuiging van de kantonrechter toewijsbaar.
Op andere blogs:
QUAFI (Werkgever vraagt niet naar gat in het CV!)
Rechtbank onbevoegd vanwege arbitragebeding
 |
 |
Eiser was als orthopeed middels een associatieovereenkomst en een toelatingsovereenkomst verbonden aan de maatschap orthopedie, thans de maatschap Chirurgie Orthopedie van het ziekenhuis. Eiser vordert te verklaren voor recht dat het ziekenhuis en MediRisk ieder voor zich zijn tekort geschoten in hun contractuele verplichtingen en onrechtmatig hebben gehandeld jegens eiser. Volgens het ziekenhuis is de rechtbank onbevoegd van het onderhavige geschil jegens haar kennis te nemen, omdat in de toelatingsovereenkomst een arbitragebeding is overeengekomen. De vorderingen van eiser tegen het ziekenhuis zijn gegrond op zowel de toelatingsovereenkomst als de vaststellingsovereenkomst.
Het enkele feit dat in de vaststellingsovereenkomst de toelatingsovereenkomst is beëindigd en geen arbitraal beding is opgenomen, oordeelt de rechtbank als een onvoldoende aanknopingspunt voor het oordeel dat partijen bij het sluiten van de vaststellingsovereenkomst voor ogen hadden dat geschillen in verband met die vaststellingsovereenkomst niet aan het scheidsgerecht zouden worden voorgelegd.
Daarbij is van belang dat de vaststellingsovereenkomst wat betreft de inhoud op dezelfde materie ziet als de toelatingsovereenkomst en partijen bij het sluiten van deze overeenkomst aanleiding zagen het scheidsgerecht de bevoegdheid te geven. Het beroep van het ziekenhuis op het arbitragebeding is naar maatsteven van redelijkheid en billijkheid niet onaanvaardbaar. De conclusie is dat de rechtbank onbevoegd is kennis te nemen van de vorderingen van eiser die zijn gebaseerd op de vaststellingsovereenkomst.
Niet valt in te zien dat eiser door een splitsing van de procedures van het ziekenhuis en MediRisk in zijn (processuele) belangen zou worden geschaad en/of dat het onrechtmatig handelen van de beide gedaagden niet meer deugdelijk zou kunnen worden beoordeeld. De enkele omstandigheid dat de vorderingen van eiser tegen de beide gedaagden deels berusten op dezelfde feiten is onvoldoende voor een ander oordeel. De rechtbank beveelt een comparitie om inlichtingen over de zaak te vragen en om te onderzoeken of partijen het op een of meer punten met elkaar eens kunnen worden.
10. Het enkele feit dat in de vaststellingsovereenkomst de toelatingsovereenkomst is beëindigd en geen arbitraal beding is opgenomen oordeelt de rechtbank als een onvoldoende aanknopingspunt voor het oordeel dat partijen bij het sluiten van de vaststellingsovereenkomst voor ogen hadden dat geschillen in verband met die vaststellingsovereenkomst niet aan het scheidsgerecht zouden worden voorgelegd. Daarbij is van belang dat, zoals overwogen, de vaststellingsovereenkomst wat betreft de inhoud op dezelfde materie ziet als de toelatingsovereenkomst en partijen bij het sluiten van deze overeenkomst aanleiding zagen het scheidsgerecht de bevoegdheid te geven over geschillen in verband daarmee te beslissen. De conclusie is dat de rechtbank ook onbevoegd is kennis te nemen van de vorderingen van [eiser in de hoofdzaak / verweerder in het incident] die zijn gebaseerd op de vaststellings-overeenkomst.
14. Van het buiten toepassing laten van een tussen partijen geldig overeengekomen arbitragebeding kan slechts sprake zijn als het beroep daarop naar maatstaven van redelijkheid en billijkheid onaanvaardbaar zou zijn. De hiervoor genoemde omstandigheden zijn onvoldoende om dat oordeel in dit geval te kunnen rechtvaardigen. Immers, uit hetgeen hiervoor onder de feiten en het geschil is weergegeven, volgt dat de gestelde toerekenbare tekortkoming en onrechtmatige daad van het ziekenhuis, als (ex) werkgever van [eiser in de hoofdzaak / verweerder in het incident], op andere feitelijke gronden berust dan de gestelde toerekenbare tekortkoming en onrechtmatige daad van Medirisk. Dat vloeit met name voort uit de omstandigheid dat de relatie tussen [eiser in de hoofdzaak / verweerder in het incident] en het ziekenhuis een geheel andere is dan de relatie tussen [eiser in de hoofdzaak / verweerder in het incident] en Medirisk. Reeds daarom valt niet in te zien dat [eiser in de hoofdzaak / verweerder in het incident] door een splitsing van de procedures in zijn (processuele) belangen zou worden geschaad en/of dat het onrechtmatig handelen van de beide gedaagden niet meer deugdelijk zou kunnen worden beoordeeld, zoals [eiser in de hoofdzaak / verweerder in het incident] ook nog heeft gesteld. De enkele omstandigheid dat de vorderingen van [eiser in de hoofdzaak / verweerder in het incident] tegen de beide gedaagden deels berusten op dezelfde feiten is onvoldoende voor een ander oordeel. De conclusie is dat het beroep van het ziekenhuis op het arbitragebeding naar maatsteven van redelijkheid en billijkheid niet onaanvaardbaar is.
16. De rechtbank zal een comparitie bevelen om inlichtingen over de zaak te vragen en om te onderzoeken of partijen het op een of meer punten met elkaar eens kunnen worden.
Inzage in digitale documentatie in octrooizaak
Vzr. Rechtbank Oost-Nederland, locatie Arnhem 1 februari 2013, 234794 / KG ZA 12-533 (Astellas Pharma inc. tegen Synthon B.V.)
 Procesrecht. Octrooirecht. Vordering ex 843a Rv jo. artikel 1019a. Op verzoek en met uiteindelijke instemming is besloten dat de behandeling van het kort geding plaatsvindt door een in het octrooirecht gespecialiseerde rechter van de rechtbank Den Haag, tevens rechter-plaatsvervanger van de rechtbank Oost-Nederland.
Procesrecht. Octrooirecht. Vordering ex 843a Rv jo. artikel 1019a. Op verzoek en met uiteindelijke instemming is besloten dat de behandeling van het kort geding plaatsvindt door een in het octrooirecht gespecialiseerde rechter van de rechtbank Den Haag, tevens rechter-plaatsvervanger van de rechtbank Oost-Nederland.
Astellas is houdster van EP 0 661 045 B1 voor een ‘Hydrogelpreparaat met aanhoudende afgifte’, geregistreerd met voorrangsregistratie in Japan. Verlof is verleend tot het leggen van conservatoir bewijsbeslag onder Synthon: bewijs dat Synthon producten heeft vervaardigd. Daartoe zijn 4 DVD+R diskettes door de deurwaarder in beslag genomen. Astellas vordert inzage in en afgifte van de door de deurwaarder in beslag genomen digitale documentatie.
Gezien de over en weer gewisselde argumenten en grotendeels tegenstrijdige deskundigenverklaringen over de oplossing in traditionele zin en de colloïdale oplossing is er serieuze twijfel mogelijk over de vraag of de Synthon-producten onder de beschermingsomvang vallen van EP 045. Vooralsnog staat inbreuk bepaald niet vast. Het is echter wel voldoende bepaald in de zin van artikel 843a Rv in welke bestanden Astellas inzage vordert.
De voorzieningenrechter bepaalt dat Astellas inzage krijgt in en door afgifte de beschikking krijgt over afschriften van het in beslag genomen materiaal die gegevens bevatten over het verrichten van een of meer handelingen door Synthon waarmee Synthon inbreuk maakt of heeft gemaakt op het octrooi in Nederland en/of in enig ander land waar dit octrooi van kracht is en/of waardoor Synthon in Nederland onrechtmatig jegens Astellas handelt of heeft gehandeld.
4.31. Welke gegevens Astellas wil inzien, is, anders dan Synthon betoogt, voldoende bepaald in de zin van artikel 843a Rv voor zover Astellas inzage vordert in de bestanden/documenten die specifiek zijn omschreven in het beslagrekest en welke Astellas in paragraaf 57 van haar pleitnota heeft herhaald ter toelichting van de bepaaldheid van haar eis. Het gaat dan om documenten die inbreuk op EP 045 in de gedesigneerde landen door Synthon en/of betrokkenheid van Synthon bij die inbreuk (kunnen) aantonen, in het bijzonder:
Vergunningen, verpakkingsmateriaal (inclusief, doch niet beperkt tot bijsluiters, PIL’s e.d.) of marketingmaterialen met betrekking tot de Synthon-producten, documenten betreffende standaardprocedures met betrekking tot de Synthon-producten en vergelijkbare documenten, aankooporders voor de Synthon-producten, facturen die werden verzonden voor de Synthon-producten, aanbiedingen van Synthon tot levering van de Synthon-producten, overeenkomsten met afnemers voor de koop of de levering van de Synthon-producten, correspondentie waaruit blijkt dat Synthon de Synthonproducten vervaardigt of heeft vervaardigd, overeenkomsten tussen Synthon en één of meer derde partijen voor het vervaardigen en leveren van de Synthon-producten (voor alle documenten geldt: ongeacht of het gaat om gedrukte, dan wel om digitale documenten, inclusief e-mails).
Voor zover Astellas heeft bedoeld om inzage te vorderen in meer dan die specifiek omschreven documenten, moet de vordering worden afgewezen vanwege de onbepaaldheid.

















