Aanwezigheid van sales- en marketingmedewerkers brengt ongewenste beïnvloeding met zich mee
CGR Codecommissie 11 juli 2013, advies AA13.038 (Sponsoring Patiëntendag) Patiëntendag. Sponsoring. Negatief advies.
Patiëntendag. Sponsoring. Negatief advies.
Het verzoek - [X] vraagt advies over de toelaatbaarheid van de volgende activiteit. Steeds vaker komen ziekenhuizen met het verzoek aan [X] om hen te ondersteunen bij het organiseren van een informatiebijeenkomst of beweegdag voor een specifieke populatie van patiënten, hierna de Patiëntendag. De toelaatbaarheid van inwilliging van het specifieke sponsorverzoek wordt door [X], aldus haar aanvraag, steeds getoetst aan de Gedragsregel Sponsoring. Naast financiële sponsoring draagt [X] bij “in kind” door mee te denken en soms zelfs mee te helpen in het organisatieproces en het programma van de dag. Dit zonder daarbij de onafhankelijkheid en geloofwaardigheid van een der partijen aan te tasten. Doel is een goede informatievoorziening richting de patiënt en zijn omgeving.
Het oordeel van de Codecommissie
De aanwezigheid van de sales- en marketingmedewerkers bij een Patiëntendag brengt naar het oordeel van de Codecommissie het evidente risico met zich voor een dergelijke ongewenste beïnvloeding, nu deze medewerkers er nu juist voor zijn opgeleid om reclame te maken voor de producten van [X]. Dat leidt ertoe dat terughoudendheid van contacten tussen deze medewerkers van [X] en het publiek op Patiëntendagen op zijn plaats is. Dit is in de aanvraag ook onderkend door de instructie op te nemen dat deze medewerkers geen contact mogen hebben met patiënten en/of het algemene publiek, maar een dergelijke algemene instructie geeft daarvoor onvoldoende garantie, met name ook nu uit de aanvraag niet duidelijk wordt waarom – indien dat contact niet plaatsvindt – [X] toch sales- en marketingmedewerkers wenst in te zetten. Bovendien is het voorkomen van beïnvloeding van de beroepsbeoefenaren in algemene zin in de aanvraag niet opgenomen, maar slechts beperkt tot de organiserende artsen.Het vorenstaande leidt ertoe dat het advies negatief dient te luiden.
Definities geneesmiddelen met een valse voorstelling van identiteit
Bijlage bij Kamerstukken II 2012/2013, 29 477, nr. 254. (Definities geneesmiddelen met een valse voorstelling van identiteit)%20wikimedia.png) Zie eerder LS&R 653. Definitie vervalste geneesmiddelen
Zie eerder LS&R 653. Definitie vervalste geneesmiddelen
Vervalste geneesmiddelen zijn geneesmiddelen met een valse voorstelling van identiteit (verpakking, etikettering, naam of samenstelling), oorsprong (fabrikant, houder van de handelsvergunning, land van herkomst) of geschiedenis (blijkend uit de documentatie over distributie). Dit is dus een ruim begrip van vervalsingen. Het omvat overigens niet inbreuken op intellectuele eigendom, welke afzonderlijk strafbaar zijn en blijven, maar in feite alle onbevoegd vervaardigde of verhandelde geneesmiddelen die op enigerlei wijze worden gepresenteerd als legaal geproduceerd of gedistribueerd.
Definitie vervalste medische hulpmiddelen
De definitie van een vervast medisch hulpmiddel is ruimer omschreven en strekt zich uit tot niet-wetsconforme medische hulpmiddelen die mogelijk een bedreiging voor de volksgezondheid vormen. Daarom zijn aanvullende criteria voor medische hulpmiddelen die niet op de Nederlandse markt gewenst zijn opgesteld, omdat zij niet voldoen aan de Europese wettelijke eisen voor markttoelating. Deze aanvullende criteria zijn:
- ontbreken van CE-markering (met uitzondering van op maat gemaakte medische hulpmiddelen en medische hulpmiddelen voor louter klinisch onderzoek).
- Substandards, een medisch hulpmiddel dat niet aan de kwaliteitseisen voldoet, maar ook niet per definitie vervalst is.
- Niet werkt conform specificaties
- Foutief gelabeld is
- Een foutieve of geen bijsluiter bevat.
Qualification opinion of a novel data driven model of disease progression and trial evaluation in mild and moderate Alzheimer’s disease
European Medicines Agency, Qualification opinion of a novel data driven model of disease progression and trial evaluation in mild and moderate Alzheimer’s disease, EMA/CHMP/SAWP/420174/2013, www.ema.europa.eu  Ongoing public consultation. Qualification opinion, model of disease progression, mild and moderate Alzheimer’s disease. On 20 March 2013 the Applicant Critical Path Global Ltd. requested qualification opinion for the 18 proposed Disease Progression and Trial Evaluation Model.
Ongoing public consultation. Qualification opinion, model of disease progression, mild and moderate Alzheimer’s disease. On 20 March 2013 the Applicant Critical Path Global Ltd. requested qualification opinion for the 18 proposed Disease Progression and Trial Evaluation Model.
The context of use: “The proposed disease progression and trial evaluation model, as defined in this document, is suitable for qualification for use in drug development as a longitudinal model for describing changes in cognition in patients with mild and moderate AD, and for use in assisting in trial designs in mild and moderate AD.” The intended scope and use for the drug development tool presented in this application are as follows: General area: the goal is for this tool to serve as a resource for sponsors designing trials across the Alzheimer’s community. It is intended that sponsors will utilize this simulation tool to provide a quantitative rationale for selection of study design and inclusion criteria. This tool could also be utilized by sponsors and health authorities for comparison of post-hoc analysis results to historical controls (priors) to minimize false positives.
Draft guideline on the evaluation of medicinal products for the treatment of irritable bowel syndrome
European Medicines Agency, Draft guideline on the evaluation of medicinal products for the treatment of irritable bowel syndrome, CPMP/EWP/785/97 Rev. 1, www.ema.europa.eu  Ongoing public consultation. Irritable Bowel Syndrome, Rome criteria, patient reported outcome (PRO), Health related Quality of Life (HrQoL).
Ongoing public consultation. Irritable Bowel Syndrome, Rome criteria, patient reported outcome (PRO), Health related Quality of Life (HrQoL).
Samenvatting: This guideline intends to address the EU regulatory position in the main topics of clinical development of new medicinal products in the treatment of patients with Irritable Bowel Syndrome (IBS). The main changes introduced into this guideline compared to the previous “Points to Consider on the Evaluation of Medicinal Products for the treatment of Irritable Bowel Syndrome”, refer to the following: The patient population to be selected has been changed from Rome II to Rome III criteria, and more flexibility towards possible future changes in the definition of the disease is introduced. The recommendation on primary endpoints to be used in confirmatory trials has been changed from a co-primary endpoint of global assessment and pain, to the evaluation of stool related abnormalities and pain. Moreover, dedicated chapters on special patient groups (gender, children and elderly) and on geographic region are introduced.
Draft inventory of paediatric medicines - Infectious diseases
European Medicines Agency, Draft inventory of paediatric medicines - Infectious diseases, EMA/PDCO/287222/2012, www.ema.europa.eu Ongoing public consultation. Objective of the list. Based on Article 43 of the European Union Paediatric Regulation the Paediatric Committee at the European Medicines Agency (PDCO) is working to establish an inventory to identify the needs in the different therapeutic areas where there should be research and development of medicinal products for children. The inventory is based on the results of a survey of all paediatric uses of medicines in Europe and on the existing list of paediatric needs established by the former Paediatric Working Party; it will be published progressively by therapeutic area.
Ongoing public consultation. Objective of the list. Based on Article 43 of the European Union Paediatric Regulation the Paediatric Committee at the European Medicines Agency (PDCO) is working to establish an inventory to identify the needs in the different therapeutic areas where there should be research and development of medicinal products for children. The inventory is based on the results of a survey of all paediatric uses of medicines in Europe and on the existing list of paediatric needs established by the former Paediatric Working Party; it will be published progressively by therapeutic area.
1. Antibacterial Medicines
2. Antimycotic Medicines
3. Antiparasitic Medicines
4. Antiviral Medicines
Further information can be found on the EMA website.
Impliciete toestemming volgt niet uit de contactlensverpakking
Rechtbank Den Haag 17 juli 2013, HA ZA 11-2462 (Novartis tegen Friederichs, in vrijwaring: Saurus)
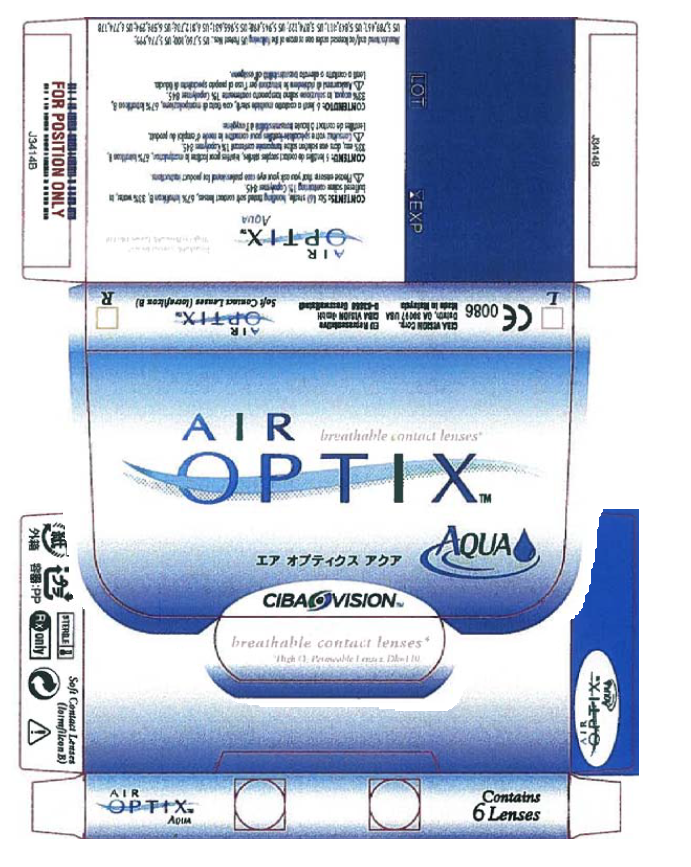 Namaak. Import in EER. Vrijwaring toegewezen. Novartis is houdster van gemeenschapswoord- /beeldmerk AIR OPTIX voor contactlenzen. Friederichs neemt o.a. deze lenzen af en verkoopt deze als groothandel. Novartis c.s. stelt dat Friederichs AIR OPTIX conctactlenzen verhandelt die niet door of met toestemming van Novartis AG in de EER in het verkeer zijn gebracht, hetgeen ook is gebleken uit de door haar verrichte proefaankoop. Saurus heeft de contactlenzen aan Friederichs geleverd.
Namaak. Import in EER. Vrijwaring toegewezen. Novartis is houdster van gemeenschapswoord- /beeldmerk AIR OPTIX voor contactlenzen. Friederichs neemt o.a. deze lenzen af en verkoopt deze als groothandel. Novartis c.s. stelt dat Friederichs AIR OPTIX conctactlenzen verhandelt die niet door of met toestemming van Novartis AG in de EER in het verkeer zijn gebracht, hetgeen ook is gebleken uit de door haar verrichte proefaankoop. Saurus heeft de contactlenzen aan Friederichs geleverd.
Er is geen sprake van uitputting. Toestemming voor het binnen de EER brengen als bedoeld in artikel 13 lid 1 GMVo kan niet worden vermoed, maar dient uitdrukkelijk dan wel impliciet te zijn. Uit de verpakking van de AIR OPTIX kan geen impliciete toestemming worden afgeleid, zeker niet nu er ook kenmerken op staan die duiden op verhandeling buiten de EER (r.o. 5.8). Friederichs heeft niet aangetoond dat er sprake is van een reëel gevaar dat Novartis c.s. haar merkrechten gebruikt om nationale markten af te schermen. (r.o. 5.10-5.12).
Met het overleggen van de facturen van en (niet succesvolle) correspondentie met Saurus over het bewijs dat met toestemming deze lenzen zijn verhandeld, heeft zij niet aangetoond dat zij al het mogelijke heeft gedaan om aan te tonen dat de merkrechten zijn uitgeput (5.17). De (neven)vorderingen worden toegewezen. De vorderingen in vrijwaring komen de rechtbank niet ongegrond of onrechtmatig voor zodat zij zullen worden toegewezen. Saurus heeft onrechtmatig gehandeld en dient Friederichs schadevergoeding aan Novartis en de proceskosten te vergoeden. Ook dient de schade die Friederichs lijdt als gevolg van het doen van opgave en het terughaalbevel te vergoeden. Vrijwaringszaak wordt toegewezen.
5.6. Friederichs stelt allereerst dat sprake is van uitputting omdat zij erop mocht vertrouwen dat Novartis c.s. met de verhandeling van de AIR OPTIX contactlenzen binnen de EER had ingestemd gelet op de verpakking van die lenzen waarop specifiek op verhandeling in de EU gerichte kenmerken zijn aangebracht, zoals de CE-markering, de vermelding van een EU Representative (Ciba Vision GmbH) en een inhoudsopgave met instructies in elf Europese talen (zie onder meer de afbeelding van de verpakking hiervoor in 3.4).
5.7. De rechtbank verwerpt dit betoog. Op grond van vaste rechtspraak geldt dat de toestemming als bedoeld in artikel 13 lid 1 GMVo niet kan worden vermoed, maar uitdrukkelijk dan wel impliciet moet zijn. Toestemming kan voortvloeien uit elementen en omstandigheden vóór, tijdens of na het binnen de EER in de handel brengen van de merkproducten, mits daaruit met zekerheid blijkt dat de merkhouder afstand heeft gedaan van zijn uitsluitende rechten met betrekking tot nauwkeurig bepaalde exemplaren van het merkproduct (vergelijk: HvJEG 1 juli 1999, LJN: BF4786, Sebago/BG Unic, HvJEG 15 oktober 2009, LJN: BK2759, Makro/Diesel).
5.8. Novartis heeft terecht aangevoerd dat uit de verpakking van de AIR OPTIX contactlenzen geen (impliciete) toestemming kan worden afgeleid voor verhandeling binnen de EER. Dat is naar het oordeel van de rechtbank al niet het geval omdat die verpakking niet uitsluitend kenmerken bevat die wijzen op verhandeling binnen de EU maar ook kenmerken die duiden op verhandeling buiten de EER. Zo stelt Novartis c.s. onweersproken dat op de verpakking niet alleen een CE markering staat maar ook markeringen die vereist zijn voor landen buiten de EU en verder dat op de verpakking naast de officiële Ciba Vision distributeur voor Europa (Ciba Vision GmbH) ook die voor de Verenigde Staten van Amerika (hierna: VS) (Ciba Vision Corp.) staat vermeld. Op de verpakking staan talen die zowel in als buiten de EU worden gesproken en er staan ook niet-Europese talen op. Tot slot vermeldt de verpakking dat het product is gefabriceerd onder gebruikmaking van (een licentie voor) met nummer vermelde Amerikaanse octrooien.
5.10. De rechtbank verwerpt dit betoog. Tussen partijen is niet in geschil dat de verkoopprijzen van Novartis c.s. van AIR OPTIX contactlenzen variëren per werelddeel (de verkoopprijzen in Azië zijn lager dan die in de VS en in de EER) en dat die verkoopprijzen ook binnen de EER variëren. Locale entiteiten in de EER passen vervolgens ook nog kortingsstaffels toe, welke staffels weer per locale entiteit (kunnen) verschillen. Dat Novartis c.s. een exclusief of selectief distributiesysteem hanteert, is niet door Friederichs aangevoerd.
5.11. De stelling van Novartis c.s. dat tussenhandelaren hun bron niet willen prijsgeven om te voorkomen dat hun afnemer bij een volgende bestelling rechtstreeks naar de voorman gaan, is in dit verband niet relevant omdat niet gesteld is dat er enig verband is met een gedraging van Novartis c.s.
5.12. De rechtbank acht hetgeen Friederichs heeft aangevoerd over het onder druk zetten van afnemers om niet aan parallelhandel te doen onvoldoende concreet om met haar te kunnen spreken van een reëel gevaar, en dus niet slechts van een theoretische mogelijkheid, dat de nationale markten door Novartis c.s. worden afgeschermd. Het had op de weg van Friederichs gelegen om meer specifiek aan te geven, en te onderbouwen, dat en op welke wijze Novartis c.s. haar afnemers onder druk zet en welke feitelijke beperkingen dit tot gevolg heeft.
5.16. Gelet op het voorgaande komt de rechtbank tot de conclusie dat Friederichs niet heeft aangetoond dat sprake is van een reëel gevaar dat Novartis c.s. haar merkrechten gebruikt om nationale markten af te schermen. Omkering van de bewijslast van uitputting is op die grond dan ook niet aan de orde.
5.17. De rechtbank ziet met inachtneming van het voorgaande ook geen reden om de bewijslast terzake uitputting om te keren op grond van redelijkheid en billijkheid. Naar het oordeel van de rechtbank heeft Friederichs met het overleggen van de facturen van Saurus en e-mailcorrespondentie waarin zij Saurus - zonder resultaat - verzoekt om bewijs dat de AIR OPTIX contactlenzen met toestemming van Novartis c.s. in de EER zijn verhandeld, niet aangetoond dat zij in redelijkheid, ook reeds ten tijde van de aankoop, al het mogelijke heeft gedaan wat gezien de omstandigheden van haar verwacht had mogen worden om aan te tonen dat terzake de verhandeling van de AIR OPTIX contactlenzen de merkrechten van Novartis c.s. zijn uitgeput. Dat Friederichs thans in bewijsnood verkeert, zoals zij stelt, maakt dit niet anders.
5.18. Tot slot verwerpt de rechtbank de stelling van Friederichs dat van toewijzing van de vorderingen een dusdanig chilling effect uitgaat dat dit op zich zelf schade toebrengt aan de legale parallelhandel omdat partijen zich uit die handel zullen terugtrekken en waren van de Merken uitsluitend nog zullen betrekken rechtstreeks van Novartis c.s. Nu niet is gebleken van een reëel gevaar van afscherming van de nationale markten door Novartis c.s., is er geen aanleiding te oordelen dat Novartis c.s. haar merkrechten niet mag handhaven als deze niet zijn uitgeput.
6.11. verklaart voor recht dat Saurus in strijd met een op haar jegens Friederichs rustende verbintenis heeft gehandeld, althans anderszins onrechtmatig jegens Friederichs heeft gehandeld, door aan Friederichs AIR OPTIX contactlenzen voorzien van de Merken te leveren die niet door of met toestemming van Novartis AG in de EER in de handel zijn gebracht;
Brief regering vervalste geneesmiddelen en medische hulpmiddelen
Stand van zaken beleidsagenda vervalste geneesmiddelen en medische hulpmiddelen, Kamerstukken II 2012/2013, 29 477, nr. 254.
%20wikimedia.png) Begripsomschrijving. Als ‘vervalst’ worden in de richtlijn aangemerkt geneesmiddelen met een valse voorstelling van identiteit (verpakking, etikettering, naam of samenstelling), oorsprong (fabrikant, houder van de handelsvergunning, land van herkomst) of geschiedenis (blijkend uit de documentatie over distributie). Dit is dus een ruime definitie van vervalsingen (zie ook bijlage 15). In feite gaat het om alle geneesmiddelen die op enigerlei wijze worden gepresenteerd als legaal geproduceerd of gedistribueerd. Het is in die definitie niet van belang of tevens geprobeerd wordt om dergelijke geneesmiddelen zo veel mogelijk te laten lijken op bestaande geneesmiddelen die al in het handelskanaal zijn (de klassieke merkvervalsing).
Begripsomschrijving. Als ‘vervalst’ worden in de richtlijn aangemerkt geneesmiddelen met een valse voorstelling van identiteit (verpakking, etikettering, naam of samenstelling), oorsprong (fabrikant, houder van de handelsvergunning, land van herkomst) of geschiedenis (blijkend uit de documentatie over distributie). Dit is dus een ruime definitie van vervalsingen (zie ook bijlage 15). In feite gaat het om alle geneesmiddelen die op enigerlei wijze worden gepresenteerd als legaal geproduceerd of gedistribueerd. Het is in die definitie niet van belang of tevens geprobeerd wordt om dergelijke geneesmiddelen zo veel mogelijk te laten lijken op bestaande geneesmiddelen die al in het handelskanaal zijn (de klassieke merkvervalsing).
Inmiddels is ook een wetsvoorstel bij uw Kamer aanhangig gemaakt dat strekt tot implementatie van de richtlijn vervalsingen waarin de nieuwe definitie is opgenomen.
Leeswijzer
In deze brief wordt de stand van zaken van de beleidsagenda 2011 op het terrein van de vervalste geneesmiddelen en de vervalste medische hulpmiddelen beschreven, zowel in nationaal als internationaal perspectief. Vervolgens wordt ingegaan op het vervolg van het VWS-beleid met betrekking tot vervalste medische producten voor de periode tot 2017. Er is voor gekozen om dit vervolg van het VWS beleid direct in deze brief uit een te zetten er komt dus geen aparte beleidsagenda. Het is de bedoeling dat de beschreven activiteiten verder worden opgepakt door de betrokken partijen.
Dit zal verder worden besproken tijdens de VWS bijeenkomsten zoals eerder genoemd in deze brief.
(...) De Europese Douane brengt jaarlijks een rapport uit over de handhaving van intellectueel eigendom. Het rapport23 over 2011 laat zien dat de Europese douane in dat jaar meer dan 90.000 casussen heeft behandeld met bijna 115 miljoen artikelen met een geschatte waarde van 1,2 miljard euro. Met een aandeel van 24% staan merkvervalste geneesmiddelen in de top 3. Overigens valt het intellectueel eigendom buiten de scope van de vervalsingen richtlijn.
Bestaande uitvinding van farmaceutisch product niet beschermd vanaf inwerkingtreding TRIPs
HvJ EU 18 juli 2013, zaak C-414/11 (Daiichi Sankyo, Sanofi-Aventis tegen DEMO) - dossier
 |
 |
1) Artikel 27 van de [TRIPs], valt onder de gemeenschappelijke handelspolitiek.
2) Artikel 27 van de [TRIPs] moet aldus worden uitgelegd dat, wanneer er geen sprake is van een afwijking op grond van de leden 2 en 3 van dat artikel, voor de uitvinding van een farmaceutisch product, zoals de werkzame chemische verbinding van een geneesmiddel, onder de voorwaarden van lid 1 van dat artikel een octrooi kan worden verleend.
3) Een octrooi dat is verkregen naar aanleiding van een aanvraag waarmee de uitvinding wordt geclaimd van zowel de wijze van vervaardiging van een farmaceutisch product als van dit farmaceutisch product als zodanig, maar dat enkel voor die wijze van vervaardiging is verleend, moet niet op grond van de voorschriften van de artikelen 27 en 70 van de Overeenkomst inzake de handelsaspecten van de intellectuele eigendom worden geacht de uitvinding van dat farmaceutische product te beschermen vanaf de inwerkingtreding van die overeenkomst.
Gestelde vragen:
1) Valt artikel 27 van de Trips-overeenkomst, dat het kader van de octrooibescherming afbakent, onder een sector waarvoor de lidstaten primair bevoegd blijven? Zo ja, staat het de lidstaten vrij, aan te nemen dat die bepaling rechtstreekse werking heeft, en kan de nationale rechter die bepaling rechtstreeks toepassen onder de voorwaarden die in zijn eigen wettelijke regeling worden gesteld?
2) Kunnen, volgens artikel 27 van de Trips-overeenkomst, chemische en farmaceutische producten het voorwerp van een octrooi vormen op voorwaarde dat zij voldoen aan de voorwaarden voor het verlenen daarvan, en zo ja, welke is de omvang van de bescherming daarvan?
3) Genieten, volgens de artikelen 27 en 70 van de Trips-overeenkomst, de onder het voorbehoud van artikel 167, lid 2, van het [EOV] vallende octrooien die vóór 7 februari 1992, dus vóór de inwerkingtreding van die overeenkomst, zijn verleend en betrekking hebben op de uitvinding van farmaceutische producten, doch wegens dat voorbehoud alleen de wijze van vervaardiging van die producten beschermen, de bescherming waarin de Trips-overeenkomst voor alle octrooien voorziet, en zo ja, welke zijn de omvang en het voorwerp van die bescherming? Met andere woorden, zijn vanaf de inwerkingtreding van die overeenkomst ook de farmaceutische producten zelf beschermd of blijft de bescherming alleen gelden voor de wijze van vervaardiging van die producten, of moet een onderscheid worden gemaakt naargelang van de inhoud van de octrooiaanvraag, namelijk naargelang uit de beschrijving van de uitvinding en daarop betrekking hebbende conclusies blijkt dat de aanvraag erop was gericht bescherming te krijgen voor een product, voor een wijze van vervaardiging of voor beide?
Overzicht Tuchtrecht week 28-29
De redactie beperkt zich tot enkel de gewezen tuchtrecht uitspraken waarin een klacht wordt toegewezen en is voornemens dit eens per twee weken te publiceren. De redactie staat open voor uw suggesties voor afwijkingen: redactie@lsenr.nl.
Regionaal Tuchtcollege Den Haag 16 juli 2013, YG3095, 2012-135 Klager verwijt de bedrijfsarts een onzorgvuldige begeleiding bij zijn arbeidsongeschiktheid en re-integratie. Meer specifiek verwijt klager de arts dat hij niet naar klager heeft geluisterd, dat hij onzorgvuldig heeft gewerkt en zijn geheimhoudingsplicht heeft geschonden. Berisping.
Klager verwijt de bedrijfsarts een onzorgvuldige begeleiding bij zijn arbeidsongeschiktheid en re-integratie. Meer specifiek verwijt klager de arts dat hij niet naar klager heeft geluisterd, dat hij onzorgvuldig heeft gewerkt en zijn geheimhoudingsplicht heeft geschonden. Berisping.
Regionaal Tuchtcollege Den Haag 16 juli 2013, YG3094, 2011-137
Klaagster verwijt de fysiotherapeut dat hij haar een therapie heeft gegeven die zich kenmerkte door het ontbreken van een behandelplan en een professioneel medisch dossier. Klaagster verwijt de fysiotherapeut voorts dat hij buiten zijn deskundigheid een diagnose heeft gesteld en dat hij zich schuldig heeft gemaakt aan grensoverschrijdend gedrag en belangenverstrengeling en dat hij uitgaat van zijn eigen (onder andere financiële) belangen. Klaagster verwijt hem tot slot dat hij een afhankelijkheidsrelatie met haar heeft opgebouwd. Schorsing van de inschrijving als fysiotherapeut in het BIG-register voor de duur van drie maanden, waarvan twee maanden voorwaardelijk.
Regionaal Tuchtcollege Amsterdam 16 juli 2013, YG3093, 2012-359V
De IGZ verwijt de verloskundige dat zij is tekortgeschoten in het verlenen van verantwoorde zorg. De verloskundige heeft gehandeld buiten haar deskundigheidsgebied door een hoog- risicobevalling in de thuissituatie te begeleiden en door haar professionele grenzen onvoldoende af te bakenen. Daarbij heeft zij onjuist geadviseerd en haar beleid niet aangepast aan het verloop van de baring. Zij heeft niet zorg gedragen voor de continuïteit van de zorg waardoor de vrouw en haar man tijdens de baring 17u alleen gelaten zijn. Bovendien was de foetale monitoring en dossiervoering onvoldoende. Gegrond, berisping.
Regionaal Tuchtcollege Amsterdam 16 juli 2013, YG3092, 2012/358V
De IGZ verwijt de verloskundige dat zij buiten haar deskundigheidsgebied is getreden door een hoog- risicobevalling te begeleiden in de thuissituatie. De verloskundige heeft dit van tevoren met de moeder afgesproken en aldus gehandeld in strijd met de professionele standaard. Voorts verwijt de IGZ de verloskundige dat zij tijdens de bevalling geen verantwoorde verloskundige zorg heeft verleend door de wensen van de ouders te laten prevaleren boven hetgeen de professionele standaard voorschrijft. Gegrond, berisping.
Regionaal Tuchtcollege Amsterdam 16 juli 2013, YG3091, 2012/357V
De IGZ verwijt de verloskundige, die zichzelf presenteert als holistisch vroedvrouw, dat zij buiten haar deskundigheidsgebied is getreden door een hoog- risicobevalling te begeleiden in de thuissituatie. De IGZ verwijt de verloskundige voorts dat zij heeft nagelaten om adequaat medisch advies te geven en de wensen van ouders heeft laten prevaleren boven het verlenen van verantwoorde verloskundige zorg. Gegrond, doorhaling met voorlopige voorziening.
Regionaal Tuchtcollege Eindhoven 10 juli 2013, YG3084, 12187b
Verpleegkundige. Klaagster verwijt verweerster dat zij onvoldoende professionele distantie in acht heeft genomen door op te treden als beroepsbeoefenaar in de zorg rondom haar eigen echtgenoot en in het bijzonder het uitvoeren van palliatieve sedatie. Zij heeft voorbehouden handelingen thuis verricht, zich niet aan de KNMG-richtlijn gehouden en niets vastgelegd. Waarschuwing.
Regionaal Tuchtcollege Eindhoven 10 juli 2013, YG3083, 12187a
Anesthesioloog. Klaagster verwijt verweerder dat hij op onzorgvuldige wijze een traject van palliatieve sedatie is ingegaan bij de echtgenoot (patiënt) van een collega van verweerder (verpleegkundige). Verweerder heeft de indicatiestelling van de verpleegkundige gevolgd zonder de patiënt te zien of te spreken. Hij heeft medicatie voorgeschreven en zich verder niet met het traject bemoeid. Verweerder heeft hiervan geen enkele notitie in het (medisch)dossier gemaakt. Waarschuwing.
Regionaal Tuchtcollege Den Haag 9 juli 2013, YG3082, 2012-051
Klager verwijt de arts dat hij zonder de toestemming van klager medische gegevens heeft verstrekt aan de gemeente en dus zijn geheimhoudingsverplichting heeft geschonden. Waarschuwing.
Regionaal Tuchtcollege Den Haag 9 juli 2013, YG3081, 2012-183
Klager verwijt de orthopeed dat hij nalatig is geweest door maandenlang de pijnklachten van klager niet serieus te nemen en op kwetsende wijze af te doen en na te laten om aanvullend onderzoek te doen, waardoor klager uiteindelijk een spoedoperatie moest ondergaan na de heupoperatie die een aantal maanden eerder had plaatsgevonden. Waarschuwing.
Regionaal Tuchtcollege Amsterdam 9 juli 2013, YG3079, 2011/511T
Klaagster verwijt de tandarts dat hij onjuiste declaraties heeft verricht, opdracht heeft gegeven om valselijk nota’s te incasseren en onzorgvuldig is omgegaan met de privacy van patiënten. Gegrond, waarschuwing.
Regionaal Tuchtcollege Eindhoven 20 juni 2013, YG3102, 1316
Psychiater. Klaagster verwijt verweerster valsheid in geschrifte en het manipuleren van gegevens om het onderzoek er zorgvuldiger en uitgebreider uit te laten zien dan het in werkelijkheid heeft plaatsgevonden. De rapportage is onvoldoende onderbouwd en klaagster is niet geïnformeerd over het inzage- en correctierecht.Er is bewust een verkeerde weergave van de mederapporteur en van klaagster en haar echtgenoot vermeld. Verweerster heeft zich niet aan de afspraken en niet aan het protocol gehouden. Gegrond, berisping.
Nota na verslag: invoering van een beperkte veredelingsvrijstelling
Nota naar aanleiding van het verslag - Wijziging van artikel 53b van de Rijksoctrooiwet 1995 in verband met de invoering van een beperkte veredelingsvrijstelling, Kamerstukken II 2012/2013, 33 365-(R1987), nr. 7.
%20wikimedia.png) De (uitgebreide) nota (betreffende het voorstel tot wijziging van de Rijksoctrooiwet 1995 in verband met de invoering van een beperkte veredelingsvrijstelling), bestaande uit:
De (uitgebreide) nota (betreffende het voorstel tot wijziging van de Rijksoctrooiwet 1995 in verband met de invoering van een beperkte veredelingsvrijstelling), bestaande uit:
1. Aanleiding en doel
2. Hoofdlijnen van het wetsvoorstel
3. Verhouding tot de TRIPS-Overeenkomst
4. Verhouding tot Richtlijn 98/44/EG
5. Administratieve lasten
6. Vergelijking met het buitenland
7. Inwerkingtreding en gevolgen voor reeds verleende licenties
8. Artikelen
9. Overig
Zie ook Brief van de staatssecretaris van economische zaken (Kamerstukken II 2012/2013, 33 365-(R1987), nr. 6.) en Nota van wijziging (Kamerstukken II 2012/2013, 33 365-(R1987), nr. 8.)
2. Hoofdlijnen van het wetsvoorstel
Toegestane handelingen bij gebruik van materiaal van plantenrassen waarop kwekersrecht of octrooirecht rust (na invoering beperkte veredelingsvrijstelling).
(...) de beperkte veredelingsvrijstelling ook geldt voor de handelingen die verband houden met de toetsing aan de vereisten voor kwekersrecht of toelating. Op deze plaats wordt verwezen naar hetgeen de regering aldaar ter motivering daarvan heeft aangegeven.3. Verhouding tot de TRIPS-Overeenkomst
Bij de onderstaande beschouwing over de TRIPS-Overeenkomst en de verschillende visies daarop, in termen van uitleg van de verschillende bepalingen, staat centraal de discussie over octrooieerbaarheid enerzijds en de reikwijdte van de bescherming van een eenmaal verleend octrooi anderzijds. Bij octrooieerbaarheid gaat het om de mogelijkheid octrooirecht te verkrijgen voor een uitvinding, die aan bepaalde wettelijke vereisten voldoet. Bij de reikwijdte van de octrooibescherming, de beschermingsomvang, gaat het om de vraag hoe ver de bescherming reikt van een verleend octrooirecht, alsmede de mogelijkheden daarop uitzonderingen te maken. Een en ander wordt onderstaand nader toegelicht bij de bespreking van de TRIPS-Overeenkomst.De voor het onderhavige wetsvoorstel meest relevante bepalingen uit de TRIPS-Overeenkomst, zijn:
− artikel 27: octrooieerbare onderwerpen;
− artikel 28: omvang van de verleende rechten;
− artikel 30: uitzonderingen op de verleende rechten.

















