Eli Lilly niet aansprakelijk voor gokverslaving na gebruik Permax

Rechtbank Midden-Nederland 1 augustus 2018, LS&R 1659; ECLI:NL:RBMNE:2018:5185 (Eiseres tegen Eli Lilly) Geneesmiddelen. Eli Lilly heeft Permax op de markt gebracht, een geneesmiddel voor de behandeling van patiënten met de ziekte van Parkinson. Het werkzame bestanddeel activeert cellen in de hersenen die gevoelig zijn voor dopamine. Eiseres is vanaf 2001 Permax gaan gebruiken en heeft bij de huisartsenpost gemeld dat zij een gokverslaving heeft. De EU Pharmacovigilance Working Party heeft in 2006 aanbevolen voor alle producten die dopamine agonisten bevatten bij de bijsluiter als mogelijke bijwerking pathologisch gokken te vermelden. Eli Lilly heeft deze informatie vervolgens aan de besluiter van Permax toegevoegd. Eiseres heeft Eli Lilly aansprakelijk gesteld voor haar gokverslaving. De rechtbank volgt de conclusies van de deskundigen dat uit de beschikbare literatuur en meldingen van bijwerkingen voor Eli Lilly niet de verplichting voortvloeide om zelf nader onderzoek te doen naar het verband tussen Permax en gokverslaving. Het handelen van Eli Lilly is niet onrechtmatig ten opzichte van eiseres. Vorderingen afgewezen.
Antilliaans Advent Ziekenhuis veroordeeld tot betaling voorschot gederfde inkomsten door onterechte weigering toegang gynaecoloog

Gerecht in eerste aanleg van Curaçao 23 oktober 2018, LS&R 1658; ECLI:NL:OGEAC:2018:255 (Eiser tegen Antilliaans Advent Ziekenhuis) Contractenrecht. Ziekenhuis weigert gynaecoloog ten onrechte de toegang en moet hem een voorschot betalen op de gederfde inkomsten. Verzoek van gedaagde afgewezen om de oproeping in vrijwaring te gelasten van de Gezondheidsinspectie. Vordering eiser tot verhoging van eerder opgelegde dwangsom afgewezen.
Bayer Pharma geen Irregular Milestones verschuldigd aan curator Leadd door stopzetting project Leadd

Rechtbank Den Haag 17 oktober 2018, LS&R 1657; ECLI:NL:RBDHA:2018:12334 (Curator tegen Bayer Pharma) Contractrecht. Octrooirecht. Wetenschapper heeft in proefopstellingen ontdekt dat een bepaald eiwit, Apoptin, alleen in kankercellen geprogrammeerde celdood (apoptose) veroorzaakt en niet in gezonde cellen. De octrooirechten op Apoptin zijn ondergebracht bij Leadd. Bayer (in de periode voor 1 juli 2011 Schering genaamd) en Leadd sloten een openbaringsovereenkomst. In een samenwerkingsovereenkomst is een bepaling betreffende "Irregular Milestones" opgenomen. Leadd is failliet gegaan. De curator stelt dat hij recht heeft op de Irregular Milestones. Indien het project echter wordt gestopt om wetenschappelijke redenen, gaan de voorwaarden uit de bepaling niet in vervulling. Omdat Schering op wetenschappelijke gronden heeft geconcludeerd dat de ontwikkeling van Apoptin Products geen kans van slagen had en het project op dat onderdeel werd stopgezet, is Bayern de Irregular Milestones niet verschuldigd. De rechtbank wijst de vordering af.
Artikel 42, zesde lid, van de Gmw heeft naast het beschermen van de volksgezondheid ook de goede werking van de interne markt voor geneesmiddelen tot doel

ABRvS 10 oktober 2018, LS&R 1656, ECLI:NL:RVS:2018:3298 (Teva tegen CtBG) Bij besluiten van 19 mei 2016 heeft het CBG aan Synthon B.V. en Mylan B.V. handelsvergunningen verleend voor de geneesmiddelen "Brabio 20mg/ml, oplossing voor injectie in een voorgevulde spuit, RVG 115980", "Sclerthon 20 mg/ml, oplossing voor injectie in een voorgevulde spuit, RVG 115987" en "Glatirameeracetaat Mylan 20mg/ml, oplossing voor injectie in een voorgevulde spuit, RVG 115993" (hierna: de vergunde geneesmiddelen). Naar het oordeel van de Afdeling heeft de rechtbank ten onrechte geoordeeld dat artikel 42, zesde lid, van de Gmw kennelijk niet strekt tot bescherming van de belangen van Teva en dat derhalve het relativiteitsvereiste in de weg staat aan vernietiging van het besluit. Naast de Gmw is derhalve Richtlijn 2001/83/EG van belang om te bepalen tot welke belangen de bescherming van artikel 42, zesde lid, van de Gmw strekt. Uit de geschiedenis van de totstandkoming van de Gmw blijkt dat in lijn met de doelstelling van Richtlijn 2001/83/EG in het wetsvoorstel is gezocht naar een balans tussen het waarborgen van kwaliteit, veiligheid en beschikbaarheid van geneesmiddelen en het zo min mogelijk belemmeren van de marktwerking. Hieruit volgt dat artikel 42, zesde lid, van de Gmw naast het beschermen van de volksgezondheid ook de goede werking van de interne markt voor geneesmiddelen tot doel heeft. Het hoger beroep is gegrond. De aangevallen uitspraak dient te worden vernietigd.
Uitspraak ingezonden door René Raggers, Claudia Zeri en Marleen van den Horst, BarentsKrans.
ABC op voorhand in strijd met artikel 3 sub c ABC-Vo verleend
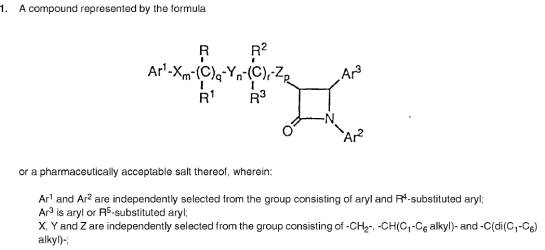
Hof Den Haag 23 oktober 2018, IEF 18051; LS&R 1655 (MSD tegen Teva, pharmachemie en centrafarm) Octrooirecht. Het Hof bevestigt het vonnis van de Voorzieningenrechter [IEF 17763] en overweegt dat naar zijn voorlopig oordeel het combinatie ABC voor ezetimibe + simvastatine in strijd met artikel 3 (c) ABC-Verordening is verleend, nu de combinatie niet het voorwerp is van de uitvinding die door het basisoctrooi wordt beschermd. Deze uitspraak sluit aan bij de beslissing van het Landgericht Düsseldorf [IEF 18014].
Prejudicieel gestelde vragen over verwijzingen naar algemene, niet-specifieke voordelen uit Claimsverordening

Prejudicieel gestelde vragen aan HvJ EU 12 juli 2018, RB 3223; LS&R 1654; C-524/18 (Doppelherz) Gezondheidsclaims. Via Minbuza. Verzoekster (Dr. Willmar Schwabe) produceert en verkoopt in Duitsland onder de benaming Tebonin® kruidengeneesmiddelen met extract van ginkgobladeren. Deze geneesmiddelen mogen worden gebruikt voor de symptomatische behandeling van hersengebonden verminderde geestelijke prestaties, waaronder vooral geheugen en concentratiestoornissen. Verweerster (Queisser Pharma) verkoopt geneesmiddelen en voedingssupplementen onder de overkoepelende merknaam Doppelherz®, waaronder het voedingssupplement Doppelherz® aktiv Ginkgo + B-Vitamine + Cholin. Op de voorzijde van de verpakking van dit product stond: “B-Vitamine und Zink) für Gehirn, Nerven, Konzentration und Gedächtnis”. Volgens verzoekster levert deze claim schending op van meerdere bepalingen van de verordening en van het in het levensmiddelenrecht en in het mededingingsrecht neergelegde algemene verbod van misleiding.
Prejudicieel gestelde vragen over afgiftevoorwaarde art. 3a) ABC-verordening

Prejudicieel gestelde vragen aan HvJ EU 17 oktober 2017, IEF 18036; IEFBE 2766; LS&R 1653; C-650/17 (Afgiftevoorwaarde ABC-verordening) Octrooirecht. Via Minbuza. Verzoekster is houdster van een Europees octrooi, dat inmiddels door tijdsverloop is vervallen. Het octrooi betreft een procedure voor de verlaging van de bloedglucosespiegel bij zoogdieren door het toedienen van zogenoemde DPPIV- remmers. De onder deze categorie van werkzame stoffen vallende werkzame stof sitagliptine werd na de datum van de aanvraag van het basisoctrooi door een licentiehoudster ontwikkeld die hiervoor een octrooi heeft verkregen op grond waarvan een aanvullend beschermingscertificaat aan haar werd afgegeven. Verzoekster verzocht bij het Duits octrooi- en merkenbureau op grond van het Duitse deel van het Europese octrooi om afgifte van een aanvullend beschermingscertificaat voor het product “sitagliptine in alle vormen die vallen onder de bescherming door het basisoctrooi”, subsidiair voor “sitagliptine, in het bijzonder sitagliptinefosfaat-monohydraat.” Ten aanzien van de vereiste vergunning voor het in de handel brengen als geneesmiddel baseerde zij zich hierbij op de toelatingen van het geneesmiddel Januvia van door het EMA. Bij besluit werd de aanvraag afgewezen, aangezien niet zou zijn voldaan aan de afgiftevoorwaarde overeenkomstig artikel 3a) van de ABC-verordening. De verwijzende rechter concludeert dat het Hof om richtsnoeren moet worden gevraagd over de uitlegging van artikel 3a) van de ABC-verordening.
Prejudicieel gestelde vragen over verplichting vermelding herkomst melk op etiket

Prejudicieel gestelde vragen aan HvJ 27 juni 2018, RB 3222; LS&R 1652; C-485/18 (Societé Groupe Lactalis) Etikettering. Via MinBuza. Bij decreet van 19.08.2016 heeft de minister-president de vermelding van de oorsprong van melk en van melk en vlees die als ingrediënt in voorverpakte levensmiddelen worden gebruikt, bij wijze van experiment, verplicht gemaakt van 01.01.2017 t/m 31.12.2018. Verzoekster (Societé Groupe Lactalis) verzoekt de verwijzende rechter om nietigverklaring, wegens bevoegdheidsoverschrijding, van DIT decreet. Verzoekster stelt dat de bestreden bepalingen, alsmede de artikelen van het wetboek van consumentenrecht waarop deze berusten, in strijd zijn met de bepalingen van de verordening aangezien zij een etiketteringsvoorschrift invoeren waarin niet is voorzien bij deze verordening, en afbreuk doen aan het vrije verkeer van goederen. Verzoekster betoogt primair dat gelet op artikel 26 jo artikel 38 van de verordening het bestreden decreet, wat betreft de etikettering, niet kan verplichten om het land van oorsprong of de plaats van herkomst van melk of melk die in bepaalde zuivelproducten als ingrediënt wordt gebruikt, te vermelden. De verwijzende rechter concludeert dat het Hof om richtsnoeren moet worden gevraagd over de uitlegging betreffende de harmonisatie van art. 26 Verordening (EU) nr. 1169/2011.
HvJ EU: enkel tabaksproducten die slechts correct kunnen worden geconsumeerd wanneer zij worden gepruimd, zijn pruimtabaksproducten

Conclusie AG HvJ EU 17 oktober 2018, LS&R 1650; C-425/17 (Günter Hartmann Tabakvertrieb) Tabak.
Artikel 2, punt 8, van richtlijn 2014/40/EU (...), gelezen in samenhang met artikel 2, punt 6, van die richtlijn, moet aldus worden uitgelegd dat enkel tabaksproducten die slechts correct kunnen worden geconsumeerd wanneer zij worden gepruimd, „tabaksproducten bestemd om te worden gepruimd” in de zin van die bepalingen vormen, hetgeen de nationale rechter dient vast te stellen op basis van alle relevante objectieve kenmerken van de betrokken producten, zoals de samenstelling, de consistentie, de aanbiedingsvorm en, in voorkomend geval, het daadwerkelijke gebruik ervan door de consument.
Eerste Kamer heeft de Wet bescherming bedrijfsgeheimen aangenomen

Met dit wetsvoorstel wordt uitvoering gegeven aan de richtlijn (PbEU 2016, L157) inzake de harmonisatie in de lidstaten van de Europese Unie van de regels betreffende de bescherming van niet-openbaar gemaakte knowhow en bedrijfsinformatie. De richtlijn geeft verder aan wat onder een bedrijfsgeheim wordt verstaan, tegen welke vormen van inbreuk daarop (onrechtmatig verkrijgen, gebruiken of openbaar maken) kan worden opgetreden en welke maatregelen, procedures en rechtsmiddelen daarvoor kunnen worden ingezet. De Eerste Kamer heeft het voorstel op 16 oktober 2018 als hamerstuk afgedaan. De fractie van de PVV is daarbij aantekening verleend.

















