Juistheid van het etiket
Rechtbank Haarlem 20 juli 2011, LJN BR3926 (Coöperatieve Zuivelondernemeing CONO B.A. tegen Gedaagde) In de hoofdzaak vordert Cono, een zuivelcoöperatie, schadevergoeding van gedaagde, een melkveehouder, wegens geleverde melk die in strijd met de regelgeving anthelmintica (diergeneesmiddel tegen leverbotbesmetting) bevatte. Die vordering wordt toegewezen omdat van eigen schuld aan de kant van Cono niet is gebleken. In de vrijwaring spreekt de melkveehouder Chanelle, de Engelse producent van het diergeneesmiddel, aan op grond van de stelling dat het (Nederlandse) etiket van het geneesmiddel ten onrechte niet vermeldde dat bij toediening van het geneesmiddel een wachttijd in acht moest worden genomen.
In de hoofdzaak vordert Cono, een zuivelcoöperatie, schadevergoeding van gedaagde, een melkveehouder, wegens geleverde melk die in strijd met de regelgeving anthelmintica (diergeneesmiddel tegen leverbotbesmetting) bevatte. Die vordering wordt toegewezen omdat van eigen schuld aan de kant van Cono niet is gebleken. In de vrijwaring spreekt de melkveehouder Chanelle, de Engelse producent van het diergeneesmiddel, aan op grond van de stelling dat het (Nederlandse) etiket van het geneesmiddel ten onrechte niet vermeldde dat bij toediening van het geneesmiddel een wachttijd in acht moest worden genomen.
De rechtbank oordeelt dat Chanelle heeft nagelaten alle relevante informatie in duidelijke en ondubbelzinnige bewoordingen op het etiket te vermelden en daardoor een product op de markt heeft gebracht waarbij het risico bestaat op een onjuiste toepassing met als gevolg dat vervuilde melk in het verkeer wordt gebracht. De fabrikant heeft daarmee onrechtmatig gehandeld jegens de melkveehouder. De schade die de melkveehouder heeft geleden, is echter mede het gevolg van het handelen van hem zelf. De rechtbank ziet daarom aanleiding de schade in gelijke mate tussen partijen te verdelen. In de ondervrijwaring spreekt Engelse producent haar Nederlandse distributeur Hofman aan, op grond van de stelling dat de verantwoordelijkheid van de foutieve tekst op het etiket bij de distributeur lag, die voor de vertaling naar het Nederlands had zorg gedragen. Die vordering wordt afgewezen. De eindverantwoordelijkheid voor de juistheid van het etiket van diergeneesmiddelen ligt bij de fabrikant. Op een farmaceutisch bedrijf rust een zware zorgplicht voor de veiligheid van haar producten en deze verantwoordelijkheid kan niet worden afgeschoven op degene die de distributie van het middel c.q. de vertaling van het etiket verzorgt.
6.14. Met Chanelle is de rechtbank evenwel van oordeel dat de schade die [A] heeft geleden, mede het gevolg is van zijn eigen handelwijze. Gelet op de artikelen over de behandeling van leverbot in het maandblad Contact van Cono had het op de weg van [A] gelegen (bij zijn dierenarts) navraag te doen over het al dan niet toedienen van de Tribex 10% tijdens de droogstand, de daarbij mogelijk in acht te nemen wachttermijn en de hoogte van de dosering. Het kan [A] worden toegerekend dat hij dit niet heeft gedaan. De rechtbank ziet daarom aanleiding de schade te verdelen in evenredigheid met de mate waarin de aan ieder toe te rekenen omstandigheden tot de schade hebben bijgedragen. Alle omstandigheden in aanmerking genomen, komt de rechtbank in dit geval tot een gelijke verdeling van de schade over [A] en Chanelle. De onder 6.12 vastgestelde schadevergoedingsplicht van Chanelle zal derhalve met 50% worden verminderd.
6.15. Slotsom van het vorenstaande is dat Chanelle zal worden veroordeeld tot betaling aan [A] van de helft van hetgeen waartoe [A] in de hoofdzaak jegens Cono wordt veroordeeld alsmede tot betaling van de helft van de door [A] geleden schade als gevolg van de weigering van Cono om melk af te nemen.
6.18. Hofman is de distributeur van Chanelle in Nederland en in dat kader heeft Chanelle haar verzocht een ontwerp te maken voor het Nederlandse etiket van Tribex 10%. Ten behoeve van het ontwerp heeft Chanelle het Engelstalige etiket en de Nederlandse registratiebeschikking aan Hofman toegezonden en op basis daarvan heeft Hofman het Nederlandse etiket opgesteld. Partijen verschillen thans van mening over de afspraken die zijn gemaakt met betrekking tot de vertaalwerkzaamheden en met name over de vraag wie verantwoordelijk is voor de juiste inhoud van het etiket. Wat er verder ook zij van de afspraken tussen partijen, de rechtbank oordeelt dat de eindverantwoordelijkheid voor de juistheid van het etiket van Tribex 10% in elk geval ligt bij Chanelle. Als farmaceutisch bedrijf rust op haar een zware zorgplicht voor de veiligheid van haar producten en zij kan deze niet afschuiven op degene die de distributie van het middel c.q. de vertaling van het etiket verzorgt. De omstandigheid dat Chanelle een in Engeland gevestigd bedrijf is en geen personeel in dienst heeft dat de Nederlandse taal beheerst, ontslaat Chanelle niet van haar zorgplicht. Het is niet te aanvaarden dat een geneesmiddel in het verkeer wordt gebracht zonder dat de producent zelf kennis heeft genomen van de inhoud van de daarvoor verstrekte registratiebeschikking en de inhoud van het etiket. Anders dan Chanelle stelt, rust op Hofman als distributeur c.q vertaler ook geen verplichting om te waarschuwen voor een verschil in voorschriften tussen de Ierse en de Nederlandse registratiebeschikking. Chanelle had als producent een dergelijk verschil zelf moeten constateren.
6.19. Slotsom van het vorenstaande is dat Chanelle zelf heeft verzuimd haar zorgplicht na te komen en Hofman daarvan geen verwijt kan maken. Van wanprestatie of onrechtmatig handelen van de zijde van Hofman is dan ook geen sprake, zodat de vordering van Chanelle zal worden afgewezen.
 De voorzieningenrechter in Amsterdam heeft de vordering van een ouderpaar afgewezen om het geneesmiddel Ataluren, waarvoor in Nederland geen handelsvergunning is verkregen of aangevraagd, aan hun aan de ziekte van Duchenne lijdende zoons van 12,5 en 15 jaar oud, ter beschikking te stellen.
De voorzieningenrechter in Amsterdam heeft de vordering van een ouderpaar afgewezen om het geneesmiddel Ataluren, waarvoor in Nederland geen handelsvergunning is verkregen of aangevraagd, aan hun aan de ziekte van Duchenne lijdende zoons van 12,5 en 15 jaar oud, ter beschikking te stellen. Auteursrecht. Licentie corporate design: logo's en huisstijl. Afbeeldingen in uitspraak. SVT heeft in opdracht van Mediq Apotheken corporate design ontwikkeld waarvoor licentie is verleend voor gebruik in Nederland. Licentievoorwaarden is overtreden door gebruik van huisstijl in België en Polen, contractuele boete van 2 miljoen wordt niet gematigd, van rechtspraak.nl:
Auteursrecht. Licentie corporate design: logo's en huisstijl. Afbeeldingen in uitspraak. SVT heeft in opdracht van Mediq Apotheken corporate design ontwikkeld waarvoor licentie is verleend voor gebruik in Nederland. Licentievoorwaarden is overtreden door gebruik van huisstijl in België en Polen, contractuele boete van 2 miljoen wordt niet gematigd, van rechtspraak.nl: 
.jpg) Met dank aan Kurt Stöpetie,
Met dank aan Kurt Stöpetie,  Wet Geneesmiddelenprijzen. Vergelijkbaar middel? Begrip sterkte: bepaald door hoeveelheid werkzame stof per doseringseenheid en niet door afgiftehoeveelheid per uur.
Wet Geneesmiddelenprijzen. Vergelijkbaar middel? Begrip sterkte: bepaald door hoeveelheid werkzame stof per doseringseenheid en niet door afgiftehoeveelheid per uur.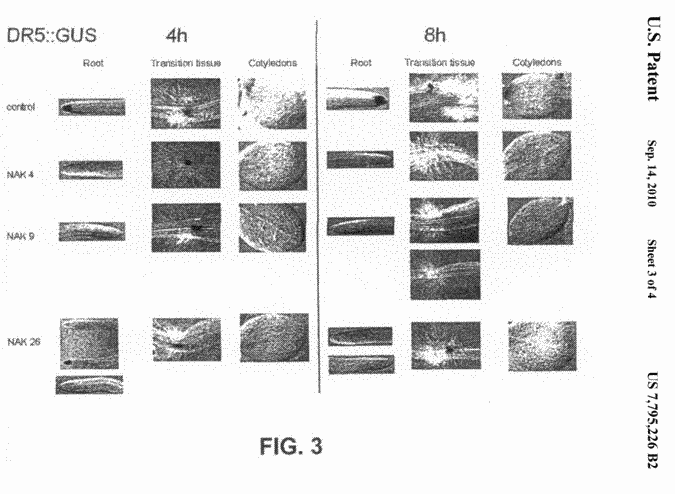 Octrooirecht. Stukgelopen samenwerking. Financiering van onderzoek, behandeling van groot aantal (ernstige) ziekten. Geschil over de constructie rondom octrooibeheer. Overdracht van "patenten, vergunningen, know-how, en intellectuele en industriële eigendomsrechten" aan nog op te richten vennootschap, nu Biotempt B.V.. Vordering is afgewezen omdat slechts het bestuur bevoegd is octrooirechtelijke vorderingen in te stellen en niet aandeelhouders. Ook onrechtmatig handelen afgewezen, nader onderbouwing behoeft volgens de rechtbank niet gezien de talloze stukken en de uitgebreide behandeling.
Octrooirecht. Stukgelopen samenwerking. Financiering van onderzoek, behandeling van groot aantal (ernstige) ziekten. Geschil over de constructie rondom octrooibeheer. Overdracht van "patenten, vergunningen, know-how, en intellectuele en industriële eigendomsrechten" aan nog op te richten vennootschap, nu Biotempt B.V.. Vordering is afgewezen omdat slechts het bestuur bevoegd is octrooirechtelijke vorderingen in te stellen en niet aandeelhouders. Ook onrechtmatig handelen afgewezen, nader onderbouwing behoeft volgens de rechtbank niet gezien de talloze stukken en de uitgebreide behandeling. Verdachte heeft een afslankinstituut geëxploiteerd, waar werd gewerkt met de zogenaamde dr. Simeonstherapie. Deze therapie combineert een laag calorisch dieet (500 calorieën) met het gebruik van het geneesmiddel hCG. hCG is het werkzame bestanddeel van het receptgeneesmiddel Pregnyl, dat in Nederland is geregistreerd voor onvruchtbaarheidsbehandelingen. hCG wordt gewonnen uit de urine van zwangere vrouwen en is bekend van de publieksactie "Moeders voor Moeders" Vergelijk met (
Verdachte heeft een afslankinstituut geëxploiteerd, waar werd gewerkt met de zogenaamde dr. Simeonstherapie. Deze therapie combineert een laag calorisch dieet (500 calorieën) met het gebruik van het geneesmiddel hCG. hCG is het werkzame bestanddeel van het receptgeneesmiddel Pregnyl, dat in Nederland is geregistreerd voor onvruchtbaarheidsbehandelingen. hCG wordt gewonnen uit de urine van zwangere vrouwen en is bekend van de publieksactie "Moeders voor Moeders" Vergelijk met ( Strafrecht. Verdachte, een gepensioneerd huisarts, heeft zijn medewerking verleend aan een afslankinstituut, waar werd gewerkt met de zogenaamde dr. Simeonstherapie. Deze therapie combineert een laag calorisch dieet (500 calorieën) met het gebruik van het geneesmiddel hCG. hCG is het werkzame bestanddeel van het receptgeneesmiddel Pregnyl, dat in Nederland is geregistreerd voor onvruchtbaarheidsbehandelingen. hCG wordt gewonnen uit de urine van zwangere vrouwen en is bekend van de publieksactie "Moeders voor Moeders". In het afslankinstituut werd het geneesmiddel gebruikt om het hongergevoel te onderdrukken. Verdachtes medeverdachten bereidden zelf injectiespuiten met hCG en gaven deze spuiten mee aan klanten. Verdachte verleende hieraan onder meer zijn medewerking door de recepten voor het geneesmiddel Pregnyl uit te schrijven. Door aldus te handelen hebben de verdachten de Geneesmiddelenwet overtreden, die geschreven is om de volksgezondheid te beschermen.
Strafrecht. Verdachte, een gepensioneerd huisarts, heeft zijn medewerking verleend aan een afslankinstituut, waar werd gewerkt met de zogenaamde dr. Simeonstherapie. Deze therapie combineert een laag calorisch dieet (500 calorieën) met het gebruik van het geneesmiddel hCG. hCG is het werkzame bestanddeel van het receptgeneesmiddel Pregnyl, dat in Nederland is geregistreerd voor onvruchtbaarheidsbehandelingen. hCG wordt gewonnen uit de urine van zwangere vrouwen en is bekend van de publieksactie "Moeders voor Moeders". In het afslankinstituut werd het geneesmiddel gebruikt om het hongergevoel te onderdrukken. Verdachtes medeverdachten bereidden zelf injectiespuiten met hCG en gaven deze spuiten mee aan klanten. Verdachte verleende hieraan onder meer zijn medewerking door de recepten voor het geneesmiddel Pregnyl uit te schrijven. Door aldus te handelen hebben de verdachten de Geneesmiddelenwet overtreden, die geschreven is om de volksgezondheid te beschermen.
















