2.4. Voor zover het project zich richt op individuele beroepsbeoefenaren, dat wil zeggen huisartsen, die niet in een formeel samenwerkingsverband – maatschap of andere rechtsvorm – maar solistisch hun praktijk uitoefenen, staat het bepaalde in art. 3 van de Gedragsregels Sponsoring aan een positief advies in de weg. De Codecommissie verwijst in dit verband naar desbetreffende overwegingen in advies A08.065 van de Codecommissie. De omstandigheid, dat uitvoering van het project kan leiden tot een verbeterde kwaliteit van de huisartspraktijk en patiëntenzorg, maakt dit oordeel niet anders. 2.7. Voor de beoordeling van de aspecten integriteit, transparantie en tegenprestatie, in het bijzonder de artikelen 4.3 en 4.4, 6.2. en 8.1 en 8.2, verdient de positie van de projectverpleegkundige bijzondere aandacht.
2.8. De Codecommissie constateert, dat in de adviesaanvraag aan de positie van de BIGgeregistreerde verpleegkundige niet of nauwelijks aandacht wordt besteed. “De door [X] ter beschikking gestelde verpleegkundige is BIG-geregistreerd en werkt op detacheringsbasis” wordt in een voetnoot gesteld. Op pagina 10 van de projectomschrijving wordt de taak van de verpleegkundige omschreven als “projectuitvoer binnen huisartsenpraktijk, patiëntenselectie uit HIS, logistieke ondersteuning, kennisoverdracht, beoordelen vragenlijsten”.
Maar of de verpleegkundige werknemer van [X] is, werknemer van een aan [X] gelieerde, met [X] te vereenzelvigen andere werkgever, door [X] ingeleende uitzendkracht, opdrachtnemer (ZZP-er) of werknemer van een opdrachtnemer van [X], met andere woorden welke contractuele verplichtingen (op basis van formeel of materieel werkgeverschap van [X], overeenkomst van opdracht of anderszins) de verpleegkundige ten opzichte van [X] heeft, blijft volstrekt onduidelijk.
Onduidelijk is dus, hoe onafhankelijk de projectverpleegkundige is ten opzichte van [X]. Daardoor blijft onduidelijk, of en in hoeverre de projectverpleegkundige vanuit de rechtsverhouding tot [X] weerstand kan bieden aan een eventuele richting projectverpleegkundige geuite wens van [X] tot het direct of indirect aanprijzen van haar geneesmiddelen of het anderszins ongewenst beïnvloeden van de beroepsbeoefenaar.
Het project roept ook prangende vragen op over patiëntgegevens, die de projectverpleegkundige, werkende weg, onder ogen krijgt, gezien haar betrokkenheid bij de eerste en bij de tweede selectie van patiënten. Zij krijgt een goed zicht op het voorschrijfgedrag van de huisartsenpraktijk en op de effectiviteit van voorgeschreven geneesmiddelen (van [X] en van ten minste 7 andere vergunninghouders) bij patiënten. In het model samenwerkingsovereenkomst tussen [X] en de huisartsenpraktijk zijn wel bepalingen opgenomen met betrekking tot privacybescherming – op dat punt rusten op de huisartsenpraktijk de verplichtingen - , maar niet blijkt van het bestaan van een overeenkomst tussen de verpleegkundige en [X] enerzijds en tussen de verpleegkundige en de huisartsenpraktijk anderzijds, waarin verplichtingen van de projectverpleegkundige tot geheimhouding van onder haar/zijn ogen gekomen patiëntgegevens zijn gewaarborgd. De passage in art. 4.6. van de samenwerkingsovereenkomst (“[X] zal, buiten de door [X] ter beschikking gestelde onafhankelijke projectverpleegkundige, geen toegang verkrijgen tot direct dan wel indirect identificeerbare gegevens vanuit de huisartspraktijk”) is niet vertrouwenwekkend.
2.10. Gelet op de hierboven gesignaleerde onduidelijkheden en vragen moet de Codecommissie constateren, dat bij de huidige stand van zaken niet wordt voldaan aan de eisen, gesteld op de onderdelen 4, 6 en 8 van de Gedragsregels Sponsoring, hetgeen in de weg staat aan een positief advies.
2.11. Bij de stukken bevinden zich de vragenlijsten en conceptbrieven aan patiënten. De Codecommissie vraagt zich bij de vragenlijsten af, waarom in de opsomming van de geneesmiddelen (vragen 11 t/m 16) niet gekozen is voor een strikt alfabetische volgorde, althans een volgorde volgens een algemeen aanvaarde indeling (art. 21.2 Leidraad Informatie UR-geneesmiddelen). Ten aanzien van de patiëntenbrieven verdient het aanbeveling, dat aan de op zich terechte vermelding van [X] als sponsor, wordt toegevoegd, dat [X] een producent van geneesmiddelen is, omdat niet aan te nemen valt, dat de gemiddelde patiënt dat weet.
2.12. De conclusie moet luiden, dat het advies niet positief kan luiden: in absolute zin wat betreft de solistische huisartsen (2.4.), in inhoudelijke zin (2.7 t/m 2.10) wat betreft de huisartsenpraktijken in een formeel samenwerkingsverband.
Uitspraak en samenvatting ingezonden door Jenny Cromsigt, V.O.
 De gezondheidsclaim dient daadwerkelijk te zijn aangemeld en ‘on hold’ te zijn geplaatst
De gezondheidsclaim dient daadwerkelijk te zijn aangemeld en ‘on hold’ te zijn geplaatst  Geneesmiddelen. Onderzoek. Tarief. Positief advies. Het verzoek - [X] treedt met dit verzoek op namens [Y]. [Y] is vergunninghouder van het geneesmiddel [A]. In juli 2009 heeft de Commissie van de Europese Gemeenschappen bij beschikking onder voorwaarde (waarover later) vergunning verleend voor het in uitzonderlijke omstandigheden in de handel brengen van het geneesmiddel [A] voor menselijk gebruik . [Geneesmiddel A] is een [vitamine Z] supplement dat in die beschikking is goedgekeurd voor de behandeling van [ziekte B]. Het gebruik van [geneesmiddel A] is voor deze indicatie wegens de zeldzaamheid van de ziekte en de beperkte beschikbaarheid van preklinische en klinische gegevens onder uitzonderlijke omstandigheden goedgekeurd.
Geneesmiddelen. Onderzoek. Tarief. Positief advies. Het verzoek - [X] treedt met dit verzoek op namens [Y]. [Y] is vergunninghouder van het geneesmiddel [A]. In juli 2009 heeft de Commissie van de Europese Gemeenschappen bij beschikking onder voorwaarde (waarover later) vergunning verleend voor het in uitzonderlijke omstandigheden in de handel brengen van het geneesmiddel [A] voor menselijk gebruik . [Geneesmiddel A] is een [vitamine Z] supplement dat in die beschikking is goedgekeurd voor de behandeling van [ziekte B]. Het gebruik van [geneesmiddel A] is voor deze indicatie wegens de zeldzaamheid van de ziekte en de beperkte beschikbaarheid van preklinische en klinische gegevens onder uitzonderlijke omstandigheden goedgekeurd. Prejudiciële vragen gesteld door Bundesgerichtshof (Duitsland).
Prejudiciële vragen gesteld door Bundesgerichtshof (Duitsland). Gezondheid. Bijzondere Reclamecode. Claims. Aanbeveling. Het betreft de advertentie waarin onder het kopje “Opvliegers? Stemmingswisselingen? Promensil helpt u door de overgang”, reclame wordt gemaakt voor Promensil.
Gezondheid. Bijzondere Reclamecode. Claims. Aanbeveling. Het betreft de advertentie waarin onder het kopje “Opvliegers? Stemmingswisselingen? Promensil helpt u door de overgang”, reclame wordt gemaakt voor Promensil. Prejudiciële vragen gesteld door Bundesgerichtshof, Duitsland
Prejudiciële vragen gesteld door Bundesgerichtshof, Duitsland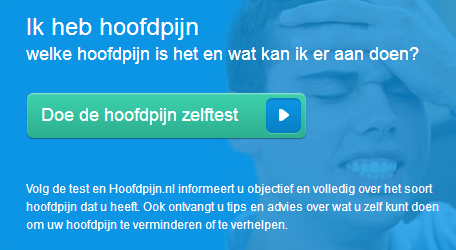 Medicijnen. Vorm van beïnvloeding. Kennelijke doel. Aanbeveling. Het betreft een radiospotje met tag-on (hierna ook: radiocommercial), waarin het volgende wordt gezegd: “Wordt jouw dag regelmatig verpest door hoofdpijn? En helpen de pijnstillers van de drogist niet? Misschien heb je migraine. Doe de hoofdpijntest op hoofdpijn.nl. Je huisarts kan specifieke medicijnen tegen migraine voorschrijven die jouw dag weer mooi kunnen maken”. Tag-on: “Laat je dag niet verpesten door migraine. Meer weten? Ga naar hoofdpijn.nl”.
Medicijnen. Vorm van beïnvloeding. Kennelijke doel. Aanbeveling. Het betreft een radiospotje met tag-on (hierna ook: radiocommercial), waarin het volgende wordt gezegd: “Wordt jouw dag regelmatig verpest door hoofdpijn? En helpen de pijnstillers van de drogist niet? Misschien heb je migraine. Doe de hoofdpijntest op hoofdpijn.nl. Je huisarts kan specifieke medicijnen tegen migraine voorschrijven die jouw dag weer mooi kunnen maken”. Tag-on: “Laat je dag niet verpesten door migraine. Meer weten? Ga naar hoofdpijn.nl”. Contractenrecht. Zorgverzekeraar. Verbod kosten verstrekking en/of toediening aan verzekerden.
Contractenrecht. Zorgverzekeraar. Verbod kosten verstrekking en/of toediening aan verzekerden.
















