State aid: Commission approves aid for innovative medical services in remote areas of Saxony
 Uit het persbericht: The European Commission has found German plans to support the setup of a platform for telemedicine services in eastern Saxony in line with EU state aid rules. The platform will allow providing medical services at a distance where the actors, for instance doctors and patients, cannot meet in the same location. The Commission concluded that, in line with EU objectives, the aid will make medical care more accessible for citizens, without unduly distorting competition in the Single Market.
Uit het persbericht: The European Commission has found German plans to support the setup of a platform for telemedicine services in eastern Saxony in line with EU state aid rules. The platform will allow providing medical services at a distance where the actors, for instance doctors and patients, cannot meet in the same location. The Commission concluded that, in line with EU objectives, the aid will make medical care more accessible for citizens, without unduly distorting competition in the Single Market.
Commission Vice-President in charge of competition policy, Joaquín Almunia, said: 'The telemedicine project in Saxony will improve access to medical services for citizens in remote areas without unduly distorting competition. This is the first Commission state aid decision in the sector and it can serve as an example for future projects.'
The rural areas of eastern Saxony are faced with a limited availability of medical care and with an ageing population. Therefore, Saxony intends to grant up to €10 million over five years for improving the medical care for several thousands of citizens in these areas by making telemedicine services generally available. Telemedicine consists in providing medical services at a distance. Among others, patients could consult their doctor by video telephony and hence avoid a long trip to the hospital.
The aid is co-financed by the European Regional Development Fund and will be awarded to a partnership between a specialist medical sponsor (Carus Consilium Sachsen GmbH) and T-Systems International GmbH, a subsidiary of Deutsche Telekom AG. Although there have been prior telemedicine projects in Germany, their scale and scope was much more limited than the current project in Saxony.
The Commission considers that the development of telemedicine services improves citizens' access to (specialised) healthcare in remote areas and thereby contributes to an objective of European interest. Moreover, the German measure will allow third parties to offer health services on the telemedicine platform for a reasonable fee that will be capped for a period of 10 years. This will limit potential distortions of competition brought about by the aid. The development of new telemedicine applications by the aid beneficiaries will also be restricted, so as to prevent that they control both the telemedicine platform and the applications and crowd out competitors from the market.
The Commission therefore concluded that the measure was in line with Article 107(3)(c) of the Treaty on the functioning of the European Union, that allows to grant aid for the development of certain economic activities, provided that it does not adversely affect trading conditions.
Background
Article 107(3)(c) of the Treaty on the functioning of the European Union (TFEU) allows Member States to grant aid for the development of certain economic activities, provided that it does not adversely affect trading conditions.
Telemedicine - the provision of healthcare services at a distance - can help improve the lives of European citizens, both patients and health professionals, while tackling the challenges to healthcare systems.1 Under Article 168(1) of the TFEU, a high level of human health protection shall be ensured in the implementation of all European Union policies. Member States are responsible for the organization and provision of healthcare.
This is the first support for telemedicine infrastructure that the Commission has cleared under EU State aid rules.
The non-confidential version of the decision will be made available under the case number SA.35679 in the State Aid Register on the DG Competition website once any confidentiality issues have been resolved. New publications of State aid decisions on the internet and in the Official Journal are listed in the State Aid Weekly e-News.
In hoedanigheid van perfusionist niet onderworpen aan tuchtrechtspraak
Centraal Tuchtcollege voor de Gezondheidszorg Den Haag, C2012.443ECLI:NL:TGZCTG:2013:139 (Verpleger in hoedanisheid van perfusionist)
 Klacht tegen perfusionist. Volgens klager is er sprake van een onnatuurlijke dood door een medische fout. Voor en tijdens de bypass-operatie waren de slangen van de hart/longmachine foutief aangesloten door de perfusionist, waardoor er lucht is gekomen in de hersenen van de inmiddels overledenpatiënt. Klager is erfgenaam van patiënt en verwijt de aangeklaagden dat zij niet adequaat als team hebbengefunctioneerd, waardoor er ernstige complicaties zijn ontstaan bij patiënt met als gevolg het overlijdendoor een medische fout. Het Regionaal Tuchtcollege oordeelt klager niet-ontvankelijk in de klacht omdat aangeklaagde als perfusionist niet is onderworpen aan de tuchtrechtspraak.Het Centraal Tuchtcollege overweegt dat, hoewel verweerster als verpleegkundige staat ingeschreven in het BIG-register, zij tijdens de operatie van de patiënt niet in die hoedanigheid heeft gehandeld maar in de hoedanigheid van perfusionist. In die hoedanigheid is verweerster op grond van artikel 47 lid 2 Wet BIG niet aan het tuchtecht onderworpen. Het beroep wordt verworpen.
Klacht tegen perfusionist. Volgens klager is er sprake van een onnatuurlijke dood door een medische fout. Voor en tijdens de bypass-operatie waren de slangen van de hart/longmachine foutief aangesloten door de perfusionist, waardoor er lucht is gekomen in de hersenen van de inmiddels overledenpatiënt. Klager is erfgenaam van patiënt en verwijt de aangeklaagden dat zij niet adequaat als team hebbengefunctioneerd, waardoor er ernstige complicaties zijn ontstaan bij patiënt met als gevolg het overlijdendoor een medische fout. Het Regionaal Tuchtcollege oordeelt klager niet-ontvankelijk in de klacht omdat aangeklaagde als perfusionist niet is onderworpen aan de tuchtrechtspraak.Het Centraal Tuchtcollege overweegt dat, hoewel verweerster als verpleegkundige staat ingeschreven in het BIG-register, zij tijdens de operatie van de patiënt niet in die hoedanigheid heeft gehandeld maar in de hoedanigheid van perfusionist. In die hoedanigheid is verweerster op grond van artikel 47 lid 2 Wet BIG niet aan het tuchtecht onderworpen. Het beroep wordt verworpen.
Begrip unitary duidt op naaldbescherming uit een stuk
Vzr. Rechtbank Den Haag 23 december 2013, KG ZA 13-1228 (B.Braun Melsungen tegen Safemedic en Troge)
 Uitspraak ingezonden door Ricardo Dijkstra, Van Doorne.
Uitspraak ingezonden door Ricardo Dijkstra, Van Doorne.
Octrooirecht. B.Braun is houdster van EP 1 911 487 B1 voor een "spring clip as needle tip protection for a safety IV catheter", dit is afsplitsing van EP 969 en subafsplitsing van EP 588 (het grootmoederoctrooi). Onder de naam Tro-Vensite bieden gedaagden een beveiligd IV katheter aan.
Omdat er wordt gesproken over een 'unitary needle guard', duidt erop dat een naaldbescherming uit één stuk bestaat. Bij een andere interpretatie is er sprake van toegevoegde materie ex 76 en 123 EOV en de kans bestaat dat conclusie 1 gedeeltelijk nietig zal worden verklaard. Niet in geschil is dat de geconstateerde nietigheid kan worden gerepareerd door de toevoeging van het kenmerk 'unitary' aan conclusie 1. Echter in dat geval valt de Tro-Vensite niet meer onder het beschermingsomvang van het octrooi. De gemiddelde vakman zal het kenmerk zo uitleggen dat de naaldbescherming bestaat uit een veerkrachtige veerklem die uit één stuk wordt gefabriceerd, daaraan voldoet de Tro-Vensite niet, omdat deze bestaat uit ten minste twee losse componenten. Alle vorderingen in conventie en in reconventie worden afgewezen.
Leestips: 5.2, 5.4 - 5.7, 5.9 - 5.10.
Nietigverklaring van ABC voor een pijnbestrijder
Rechtbank Den Haag 11 december 2013, HA ZA 12-1336 (Mylan tegen Janssen Pharmaceuticals)
 Uitspraak ingezonden door Marleen van den Horst, BarentsKrans.
Uitspraak ingezonden door Marleen van den Horst, BarentsKrans.
Octrooirecht. ABC. Geen 1019h Rv-proceskostenveroordeling. Janssen was houdster van EP 566709 B3, voor een Preparaat dat een tramadolverbinding en aceetaminofen bevat en de toepassing ervan (pijnstiller). Hiervoor is een ABC 300152 verleend. Mylan vordert vernietiging van het EP 709 en nietigverlaring van het ABC, omdat er sprake is van toegevoegde materie en gebrek aan inventiviteit.
Van een gemiddelde vakman die op zoek is naar een alternatief voor pijnbestrijding zal te rade gaan bij documenten die zich bezighouden met hetzelfde probleem, de toepassing van geneesmiddelen voor de bestrijding van ernstige pijn. Uit de tabel van Ganzer zou de vakman leren dat bepaalde combinaties succesvol kunnen worden aangewend bij de bestrijding van pijn als gevolg van gevorderde tumoren. Dat alternatief vergt geen inventieve arbeid. Een keuze uit een van de alternatieven kan niet als inventief worden aangemerkt.
De rechtbank verklaart ABC nietig, maar er is vanwege het verstrijken van het octrooi geen belang bij de vernietiging hiervan. Artikel 1019h Rv is (onder verwijzing naar Bericap) niet van toepassing omdat het een zuivere nietigheidsactie betreft.
3.3.4. De gemiddelde vakman zou dit probleem op grond van zijn algemene vakkennis of door kennis te nemen van Ganzer oplossen door de twee extra actieve verbindingen weg te laten.
4.4. Het objectieve technische probleem uitgaande van US 589 is dus niet het voorzien in een verbeterde pijnstillende werking van de samenstelling, maar slechts het verschaffen van een alternatief voor de door US 589 geopenbaarde samenstelling met behoud van de pijnstillende werking.
4.5. Van de gemiddelde vakman die op zoek is naar een dergelijk alternatief mag verwacht worden dat hij zal onderzoeken welke alternatieven mogelijk al zijn gevonden. Daarvoor zal hij te rade gaan bij documenten die zich bezighouden met hetzelfde probleem, de toepassing van geneesmiddelen voor de bestrijding van ernstige pijn. De rechtbank ziet zonder nadere motivering, die ontbreekt, niet in waarom de gemiddelde vakman daarbij geen publicaties zou raadplegen die zich richten op pijnbestrjding bij medische specialismen waarin regelmatig emstige pijn wordt bestreden. De rechtbank acht dan ook aannemelijk dat de gemiddelde vakman onder meer Ganzer in zijn beschotiwingen zou betrekken, dat zich immers evenals het octrooi bezighoudt met bestrijding van ernstige pijn. De gemiddelde vakman zou Ganzer niet terzijde schuiven alleen omdat het artikel specifiek ziet op pijn door tumoren in het hoofd- en halsgebied.
4.6. Uit tabel 6 van Ganzer zou de vakman leren dat de combinatie van ben-u-ron en tramal succesvol kan worden aangewend bij de bestrijding van pijn als gevolg van gevorderde tumoren. De rechtbank acht aannemelijk dat hij deze aanwijzing ter harte zou nemen in de redelijke verwachting een bruikbaar alternatief te vinden voor de samenstelling
van voorbeeld 23 van US 589 en zo zou komen tot de maatregelen van conclusie 1. Dat alternatief vergt aldus geen inventieve arbeid.
4.7. Daaraan doet niet af dat Ganzer ook andere combinaties dan die van ben-u-ron en tramal openbaart zoals ben-u-ron en MST of Truxal. Mogelijk leiden die tot andere voor de hand liggende alternatieven, maar dat maakt de maatregelen van conclusie 1 nog altijd niet meer dan de keuze uit één van de voor de hand liggende alternatieven. Een keuze uit een
van deze alternatieven kan niet als inventief worden aangemerkt.
4.10. Het voorgaande leidt er toe dat ABC 300152 nietig dient te worden verklaard. Vernietiging van EP 709 moet echter worden afgewezen omdat de geldigheidsduur al is verstreken en een belang van Mylan bij vernietiging van het vervallen octrooi door haar niet is gesteld en evenmin is gebleken. Aan de gevorderde voorlopige voorziening wordt niet toegekomen nu een eindbeslissing wordt gegeven.
Onduidelijk begrip aanvangsdosering voor titratie
Vzr. Rechtbank Den Haag 23 december 2013, KG ZA 13-1160 (Novartis tegen Alvogen en Focus Farma)
 Uitspraak ingezonden door Marleen van den Horst en Claudia Zeri, Barents Krants.
Uitspraak ingezonden door Marleen van den Horst en Claudia Zeri, Barents Krants.
Octrooirecht. Impliciete openbaarmaking. Begrip aanvangsdosering. Novartis is houdster van EP 2 292 219 waarbij rivastigmine (actief bestanddeel tegen de progressie van dementie of de ziekte van Alzheimer) via een pleister kan worden toegediend, middels geleidelijke dosering oftewel titratie.
Op 12 maart 2013 heeft Alvogen Ipco marktvergunningen verkregen voor Nederland met betrekking tot generieke rivastigminepleisters. Focus Farma is producent en leverancier van de generieke pleisters. Alvogen heeft haar producten doen opnemen in de zogenaamde G-standaard. Volgens Alvogen is onduidelijk wat het octrooi verstaat onder het begrip aanvangsdosis (starting dose), waarin de voorzieningenrechter haar volgt. Er is een serieuze, niet te verwaarlozen kans bestaat dat het octrooi in de oppositieprocedure zal worden herroepen of in een nietigheidsprocedure zal worden vernietigd en het gevorderde wordt afgewezen. Novartis wordt veroordeeld in de proceskosten ad €163.141,81.
4.6. Voorshands wordt met Novartis geoordeeld dat in in ieder geval voorbeeld IV (Pharmacokinetic properties) voor de gemiddelde vakman duidelijk en ondubbelzinnig een behandeling van Alzheimer patiënten" wordt geopenbaard waarbij rivastigrnine wordt toegediend in een aanvangsdosis die wordt afgegeven door een ITS van 5 cm². Dat dit de aanvangsdosis is, volgt, zoals Novartis terecht aanvoert, uit de vermelding dat het hier gaat om een ascending dose-proportionality study en uit de hiervoor op pagina 6 weergegeven tabel van voorbeeld IV (18 patients in the 5 cm²) dose). Vooralsnog acht de voorzieningenrechter tevens aannemelijk dat de vakman zal begrijpen dat het hier gaat om een dosis per 24 uur gezien de vergelijking met de BID Exelon capsules waarvan de toegediende hoeveelheden blijkens Table 1 per dag worden weergegeven.
4.9. Een impliciete openbaring is alleen aan de orde indien de gemiddelde vakman op grond van zijn algemene vakkennis in het uitdrukkelijk geopenbaarde zonder meer zou meelezen dat de geclaimde voordelige effecten van de behandeling, zoals de mogelijkheid bij de behandeling een hogere aanvangsdosis te gebruiken en het verlagen van het aantal titratiestappen, slechts afhankelijk zijn van de aanvangsdosis, ongeacht de verdere eigenschappen van de TIS. In dat geval zou hij voor de uitdrukkelijk geopenbaarde ITS#2 lezen: iedere TIS met dezelfde aanvangsdosis. Voorshands ontbreken echter aanwijzingen, laat staan voldoende overtuigende aanwijzingen dat de vakman het octrooi daadwerkelijk I aldus zal lezen.
4.10. Novartis heeft gewezen op voorbeeld III, maar daaruit kan de vakman niet meer I afleiden dan dat de in vergelijking met TTS#l additionele hechtlaag van TTS#2 niet van invloed is op de mate waarin de actieve stof door de huid wordt doorgelaten. Daaruit is niet duidelijk en ondubbelzinnig af te leiden dat dat ook geldt voor andere eigenschappen van de TTS of dat de voordelige effecten slechts met die mate van doorlaatbaarheid samenhangen.4.11. Novartis wijst voorts op de hiervoor weergegeven passage op pagina 11 van WO 407 waar voordelen worden genoemd van such compositions, verwijzend naar de TTS volgens de uitvinding. Ook op deze plaats wordt die ITS niet in verband gebracht met een bepaalde aanvangsdosis. AI om die reden geeft dit geen grond voor de veronderstelling dat de vakman een ITS met een bepaalde aanvangsdosis zou meelezen op de manier die Novartis bepleit.
Apothekers treffen privacybeschermende maatregelen na onderzoeken
.jpg) CBP publiceert onderzoeken gebruik en uitwisseling patiëntgegevens door apothekers
CBP publiceert onderzoeken gebruik en uitwisseling patiëntgegevens door apothekers
Uit de Mededeling: Het College bescherming persoonsgegevens (CBP) heeft tijdens onderzoeken naar de verwerking van medische gegevens door apothekers overtredingen van de wet geconstateerd. Apothekers zijn net als andere zorgverleners gebonden aan het medisch beroepsgeheim. Zij hebben de plicht om hun patiëntgegevens vertrouwelijk te behandelen, adequaat te beschermen en te beveiligen. Dat geldt zowel intern als extern richting derden. Het CBP heeft geconstateerd dat alle, steekproefsgewijs onderzochte apothekers op verschillende punten tekortschoten. Zo bleken vier onderzochte apothekers in strijd met hun medisch beroepsgeheim patiëntgegevens te hebben verstrekt aan een fabrikant van incontinentiemateriaal. Vier andere apothekers bleken tijdens een onderzoek naar de beveiliging van de toegang van patiëntgegevens niet alle benodigde maatregelen te hebben genomen die gelden voor een adequate beveiliging van patiëntgegevens.
Inmiddels zijn de meeste overtredingen beëindigd. Ten aanzien van de geconstateerde overtredingen die nog openstaan in het kader van de toegangsbeveiliging, hebben de betrokken apothekers aangegeven dat deze binnen afzienbare tijd zullen zijn beëindigd. De bescherming van medische gegevens is een van de speerpunten van het CBP. De toezichthouder zal de komende tijd controleren of alle geconstateerde overtredingen in de apothekersbranche zijn beëindigd.
Profielen van incontinentiepatiënten
Het CBP heeft bij vier apotheken onderzoek gedaan naar de verwerking van medische persoonsgegevens ten behoeve van het bepalen van patiëntprofielen met betrekking tot incontinentiemateriaal. Het bepalen van deze patiëntprofielen werd uitbesteed aan een eveneens door het CBP onderzochte derde partij, te weten een fabrikant van incontinentiemateriaal.
Het CBP constateerde dat de apothekers onvoldoende waarborgen hadden getroffen om de patiëntgegevens te beschermen. Zo ontbrak een zogeheten bewerkersovereenkomst tussen de apotheken en de fabrikant waarin afspraken opgenomen moeten zijn over onder meer de beveiliging van de gegevens en het doel waarvoor de bewerker de verschillende gegevens verwerkt. Inmiddels heeft de fabrikant met de onderzochte apothekers met wie nog wordt samengewerkt een bewerkersovereenkomst gesloten waardoor de overtredingen op dit punt zijn beëindigd. Uit het onderzoek bleek ook dat niet alle apothekers aan alle patiënten toestemming hebben gevraagd om hun patiëntgegevens door te geven aan de fabrikant. Dat was in strijd met de wet. Deze overtredingen zijn inmiddels beëindigd omdat deze patiënten alsnog toestemming hebben gegeven en de gegevens van patiënten die geen toestemming hebben gegeven, zijn vernietigd.
Uitwisseling gegevens
Uit het onderzoek naar de beveiliging van de toegang tot patiëntgegevens bleek dat vier (andere) apothekers niet alle vereiste maatregelen hebben genomen om te zorgen dat alleen bevoegde personen toegang hebben tot hun patiëntgegevens. Dat geldt bijvoorbeeld voor de eis van de zogeheten twee-factor authenticatie (bijvoorbeeld een chipcard in combinatie met een pincode) voor toegang tot het systeem. De apothekers bleken enkel gebruik te maken van wachtwoorden om in te loggen en dat is onvoldoende. Twee apothekers hebben aangegeven maatregelen te hebben genomen waardoor de overtredingen binnen afzienbare tijd zullen zijn beëindigd. Een apotheker heeft na de vaststelling van het onderzoeksrapport laten weten dat de overtreding inmiddels is beëindigd. Het CBP zal binnenkort controleren in hoeverre de geconstateerde overtredingen nog voortduren.
Besluit genetisch gemodificeerd aardappelproduct nietigverklaard
Gerecht EU 13 december 2013, T-240/10 (Hongarije/Commissie) - dossier - persberichtHarmonisatie van wetgevingen – Doelbewuste introductie van ggo’s in het milieu – Procedure voor vergunning voor in de handel brengen aardappelproduct (Solanum tuberosum L. lijn EH92527-1), genetisch gemodificeerd met het oog op een groter gehalte aan amylopectine in het zetmeel – Wetenschappelijke adviezen van EFSA – Comitologie – Regelgevingsprocedure – Schending van wezenlijke vormvoorschriften – Ambtshalve opgeworpen.
Nietigverklaring van besluit C(2010) 1193 van de Commissie van 2 maart 2010 betreffende het in de handel brengen, overeenkomstig richtlijn 2001/18/EG van het Europees Parlement en de Raad, van een aardappelproduct (Solanum tuberosum L. lijn EH92527-1), genetisch gemodificeerd met het oog op een groter gehalte aan amylopectine in het zetmeel (PB L 53, blz. 11) en van besluit C(2010) 1196 van de Commissie van 2 maart 2010 tot verlening van een vergunning voor het in de handel brengen van diervoeders die zijn geproduceerd met de genetisch gemodificeerde aardappel EH92527-1 (BPS-252719) en de onvoorziene of technisch niet te voorkomen aanwezigheid van die aardappel in levensmiddelen en andere diervoeders krachtens verordening (EG) nr. 1829/2003 van het Europees Parlement en de Raad (PB L 53, blz. 15).
Nakoming van de verplichting om de gewijzigde ontwerpen van de bestreden besluiten aan de bevoegde regelgevende comités voor te leggen
80 Vaststaat dat de door de Commissie voorgestelde maatregelen moesten worden vastgesteld volgens de regelgevingsprocedure zoals ingevoerd bij artikel 5 van besluit 1999/468. Deze procedure kent de verplichting voor de Commissie om een ontwerp van de te nemen maatregelen voor te leggen aan het bevoegde regelgevend comité. Indien het comité niet bij gekwalificeerde meerderheid een advies vaststelt, moet de Commissie onverwijld een voorstel betreffende de te nemen maatregelen bij de Raad indienen.
87 Bijgevolg moet worden vastgesteld dat de Commissie met de vaststelling van de bestreden besluiten zonder de bevoegde regelgevende comités gewijzigde ontwerpen van die vergunningsbesluiten voor te leggen, de procedurele verplichtingen niet is nagekomen die op haar rusten krachtens artikel 5 van besluit 1999/468 en de bepalingen van richtlijn 2001/18 en verordening nr. 1829/2003 die daarnaar verwijzen, en tegelijk ook voor elk van die besluiten de wezenlijke vormvoorschriften in de zin van artikel 263, tweede alinea, VWEU heeft geschonden, wat het Gerecht ambtshalve moet opwerpen. Derhalve zijn deze besluiten krachtens artikel 264, eerste alinea, VWEU nietig in hun geheel.
Overeenstemming, of geen inhoudelijke wijziging, van de bestreden besluiten en de eerdere ontwerpen
98 Daarnaast moet worden gewezen op drie belangrijke verschillen tussen het geconsolideerde advies van de EFSA van 2009, genoemd in punt 12 van de considerans van besluit 2010/135 en in punt 8 van de considerans van besluit 2010/136, en de eerdere adviezen van de EFSA, zonder dat uitspraak behoeft te worden gedaan over de gegrondheid van de risicobeoordelingen in elk van die adviezen. In casu hebben die verschillen betrekking op de opsteller van de wetenschappelijke adviezen waarop respectievelijk de gewijzigde en de eerdere ontwerpen van vergunningsbesluiten zijn gebaseerd, op de inhoud van de conclusies in die adviezen en op het voorkomen van minderheidsstandpunten in genoemde adviezen. In de eerste plaats hebben meer personen aan de opstelling van het geconsolideerde advies van de EFSA van 2009 meegewerkt dan aan de adviezen en verklaringen van 2004, 2005 en 2007, die enkel uitgingen van het ggo-panel, omdat het eerstgenoemde ook van het BIOHAZ-panel afkomstig is en volgens het nieuwe mandaat van de Commissie in nauwe samenwerking met het EMA is geschreven. In de tweede plaats leggen de conclusies in het geconsolideerde advies van de EFSA van 2009, waarop de gewijzigde voorstellen zijn gebaseerd, veel meer de nadruk op de wetenschappelijke onzekerheid („niet geheel begrepen”, „beperkingen”, „onzekerheden”, „onwaarschijnlijk”) en de gevaren („wereldwijd een bron van zorg”) dan de conclusies in het advies van de EFSA van 2005 („geen reden te veronderstellen”, „vormt geen bijkomend risico”, „geen risico van betekenis”, „werden geen schadelijke gevolgen voor het milieu waargenomen en zijn die ook niet waarschijnlijk”) en de verklaring van de EFSA van 2007 („zal niet in gevaar zijn”, „uiterst lage waarschijnlijkheid”, „zeer onwaarschijnlijk”, „vormt geen risico”), waarop de eerdere ontwerpen zijn gebaseerd. In de derde plaats bevat het geconsolideerde advies van de EFSA van 2009 minderheidsstandpunten van twee leden van het BIOHAZ-panel, die de wetenschappelijk onzekerheid met klem benadrukken, terwijl het advies van de EFSA van 2005 en de verklaring van de EFSA van 2007 geen minderheidsstandpunten bevatten.
Beroep tot nietigverklaring
112 Gelet op een en ander, en zonder dat de gegrondheid van de door Hongarije aangevoerde middelen behoeft te worden onderzocht, slaagt het beroep tot nietigverklaring wat de primaire conclusies aangaat.
Drie varianten voor de zorgbasisverzekering
RCC 2 december 2013, dossiernr. 2013/00829 (Zilveren Kruis)
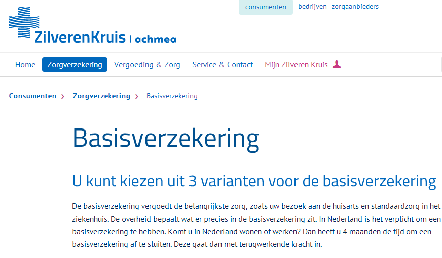 Zorgverzekering. Aanbeveling. Het betreft adverteerders webpagina zilverenkruis.nl/consumenten/zorgverzekering/basisverzekering, waarop onder het kopje “Basisverzekering. U kunt kiezen uit 3 varianten voor de basisverzekering” deze “Varianten” als volgt worden vermeld: “Beter Af Exclusief”, “Beter Af” en “Beter Af Selectief”. Daarbij staat een summiere toelichting en wordt de voor elk van de verzekeringen verschuldigde maandpremie vermeld.
Zorgverzekering. Aanbeveling. Het betreft adverteerders webpagina zilverenkruis.nl/consumenten/zorgverzekering/basisverzekering, waarop onder het kopje “Basisverzekering. U kunt kiezen uit 3 varianten voor de basisverzekering” deze “Varianten” als volgt worden vermeld: “Beter Af Exclusief”, “Beter Af” en “Beter Af Selectief”. Daarbij staat een summiere toelichting en wordt de voor elk van de verzekeringen verschuldigde maandpremie vermeld.
De klacht Er worden drie basisverzekeringen aangeboden, waarvan er één geen basisverzekering is, maar een basisverzekering inclusief luxe aanvullend pakket.
Bij doorklikken naar de polis van de “Beter Af Exclusief”-verzekering blijkt dat het om een polis inclusief aanvullend pakket gaat. Volgens de website zou dit de enige restitutieverzekering zijn, maar er bestaat ook een gewone, losse restitutieverzekering. Klanten worden hierdoor op kosten gejaagd. Ze denken een basisverzekering te nemen, maar ongemerkt krijgen ze er een aanvullende verzekering bij.
Het verweer
Naar aanleiding van de klacht, luidende dat op de website niet direct zichtbaar is dat de “Beter Af Exclusief Polis” niet alleen een basisverzekering is maar bestaat uit de “Beter Af Restitutie Polis” met een aanvullend “Beter Af Exclusief Pakket”, heeft adverteerder laten weten de website te hebben aangepast. Nu wordt op de webpagina “Zorgverzekering” direct, door middel van een asterisk, duidelijk gemaakt dat de “Beter Af Exclusief Polis” bestaat uit een “Beter Af Restitutie Polis” met een “Beter Af Exclusief Pakket”. Ook op de daarop volgende pagina’s wordt duidelijk vermeld dat de “Beter Af Exclusief Polis” een gecombineerde verzekering is.
Het oordeel van de Commissie
Door onder het kopje “Basisverzekering. U kunt kiezen uit 3 varianten voor de basisverzekering” de drie “Varianten” te vermelden, voorzien van een uiterst korte toelichting, wordt de indruk gewekt dat deze drie verzekeringen varianten op de basisverzekering zijn. In werkelijkheid bestaat één van deze varianten, te weten de “Beter Af Exclusief”-verzekering uit een basisverzekering én een aanvullende verzekering, namelijk de “Beter Af Restitutie”-verzekering. Dit blijkt niet uit de gewraakte uiting.Blijkens het vorenstaande is, naar het oordeel van de Commissie, sprake van het verborgen houden van essentiële informatie die de gemiddelde consument nodig heeft om een geïnformeerd besluit over een transactie te nemen als bedoeld in artikel 8.3 onder c van de Nederlandse Reclame Code (NRC). Nu de gemiddelde consument er bovendien toe kan worden gebracht een besluit over een transactie te nemen, dat hij anders niet had genomen, is de uiting misleidend en daardoor oneerlijk in de zin van artikel 7 NRC.
De beslissing
Op grond van het hierboven overwogene acht de Commissie de reclame-uiting in strijd met artikel 7 NRC en beveelt zij adverteerder aan om niet meer op een dergelijke wijze reclame te maken.
HvJ EU: Mogelijkheid om meerdere ABC's te verkrijgen op basis van eenzelfde octrooi
HvJ EU 12 december 2013, zaaknr. C-484/12 (Georgetown University tegen Octrooicentrum Nederland) - dossier
.gif) Prejudiciële vragen gesteld door Rechtbank ’s Gravenhage. Uitlegging van de artikelen 3, sub c, en 14, sub b, van de ABC-verordening. Mogelijkheid om meerdere aanvullende beschermingscertificaten te verkrijgen op basis van eenzelfde octrooi. Het Hof verklaart voor recht:
Prejudiciële vragen gesteld door Rechtbank ’s Gravenhage. Uitlegging van de artikelen 3, sub c, en 14, sub b, van de ABC-verordening. Mogelijkheid om meerdere aanvullende beschermingscertificaten te verkrijgen op basis van eenzelfde octrooi. Het Hof verklaart voor recht:
In omstandigheden als die in het hoofdgeding, waarin op basis van een basisoctrooi en de vergunning voor het in de handel brengen van een geneesmiddel dat bestaat uit een samenstelling van meerdere werkzame stoffen, de houder van dit octrooi reeds een aanvullend beschermingscertificaat heeft verkregen voor deze samenstelling van werkzame stoffen die door dit octrooi wordt beschermd in de zin van artikel 3, sub a, van [ABC-verordening voor geneesmiddelen], moet artikel 3, sub c, van deze verordening aldus worden uitgelegd dat het niet eraan in de weg staat dat deze houder ook een aanvullend beschermingscertificaat verkrijgt voor één van deze werkzame stoffen die afzonderlijk ook als zodanig door dit octrooi wordt beschermd.
Gestelde vragen:
1) Verzet verordening [...] nr. 469/2009 [...], meer in het bijzonder artikel 3, aanhef en onder c daarvan, zich ertegen dat, in de situatie dat een van kracht zijnd basisoctrooi meerdere producten beschermt, aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten?
2) Indien de eerste vraag bevestigend moet worden beantwoord, hoe dient artikel 3, aanhef en onder c, van de verordening te worden uitgelegd in de situatie dat een van kracht zijnd basisoctrooi meerdere producten beschermt en op de aanvraagdatum van een certificaat voor één van de door het basisoctrooi beschermde producten (A), weliswaar nog geen certificaten waren verkregen voor andere producten (B, C) beschermd door hetzelfde basisoctrooi, doch op die aanvragen voor de producten (B, C) certificaten zijn afgegeven voordat op de aanvrage voor een certificaat voor het eerstgenoemde product (A) is beslist?
3) Is het voor de beantwoording van de vorige vraag van belang of de aanvrage voor één van de door het basisoctrooi beschermde producten (A) op dezelfde datum is ingediend als de aanvragen voor andere producten (B, C) beschermd door hetzelfde basisoctrooi?
4) Indien de eerste vraag bevestigend moet worden beantwoord, kan een certificaat worden afgegeven voor een door een van kracht zijnd basisoctrooi beschermd product, indien reeds eerder voor een ander door hetzelfde basisoctrooi beschermd product een certificaat is afgegeven, maar van dit laatste certificaat door de aanvrager afstand wordt gedaan met het oogmerk een nieuw certificaat te kunnen verkrijgen op basis van hetzelfde basisoctrooi?
5) Indien het voor beantwoording van de vorige vraag relevant is of de afstand terugwerkende kracht heeft, wordt de vraag of afstand terugwerkende kracht heeft beheerst door artikel 14, aanhef en onder b, van de verordening of door het nationale recht? Indien de vraag of afstand terugwerkende kracht heeft wordt beheerst door artikel 14, aanhef en onder b, van de verordening, dient die bepaling zo te worden uitgelegd dat afstand terugwerkende kracht heeft?
HvJ EU: Geen tweede ABC bij samenstelling met andere werkzame stof
HvJ EU 12 december 2013, zaak C-443/12 (Actavis tegen Sanofi) - dossier
 Prejudiciële vragen gesteld door High Court of Justice, Chancery Division.
Prejudiciële vragen gesteld door High Court of Justice, Chancery Division.
Octrooirecht. Aanvullend beschermingscertificaat. Uitlegging van artikel 3, sub a en c, van verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen (PB L 152, blz. 1) – Voorwaarden voor afgifte van een aanvullend beschermingscertificaat – Begrip „product dat wordt beschermd door een van kracht zijnd basisoctrooi” – Criteria – Mogelijkheid een certificaat af te geven voor elk geneesmiddel in geval van een basisoctrooi voor meerdere geneesmiddelen. Het hof verklaart voor recht:
In omstandigheden als die in het hoofdgeding, waarin een octrooihouder op basis van een octrooi dat een vernieuwende werkzame stof beschermt en van een vergunning voor het in de handel brengen van een geneesmiddel dat deze stof als enige werkzame stof bevat, reeds een aanvullend beschermingscertificaat voor deze werkzame stof heeft verkregen, zodat hij zich kon verzetten tegen het gebruik van deze werkzame stof alleen of in combinatie met andere werkzame stoffen, moet artikel 3, sub c, van [ABC verordening] aldus worden uitgelegd dat het eraan in de weg staat dat op basis van hetzelfde octrooi, maar van een latere vergunning voor het in de handel brengen van een ander geneesmiddel dat deze werkzame stof in samenstelling met een andere, als zodanig door dit octrooi niet beschermde werkzame stof bevat, de octrooihouder een tweede aanvullend beschermingscertificaat voor deze samenstelling van werkzame stoffen verkrijgt.
Gestelde vragen:
„1) Wat zijn de criteria voor de beslissing of ,het product wordt beschermd door een van kracht zijnd basisoctrooi’ in de zin van artikel 3, sub a, van verordening [nr. 469/2009]?
2) Staat verordening [nr. 469/2009], en met name artikel 3, sub c, ervan, in een situatie waarin meerdere producten worden beschermd door een van kracht zijnd basisoctrooi eraan in de weg dat voor elk van de beschermde producten een certificaat wordt afgegeven aan de octrooihouder?”

















