Conclusie A-G: Richtlijn medische hulpmiddelen staat indeling product als geneesmiddel toe
Conclusie A-G HvJ EU 30 mei 2013, zaak C-109/12 (Laboratoires Lyocentre)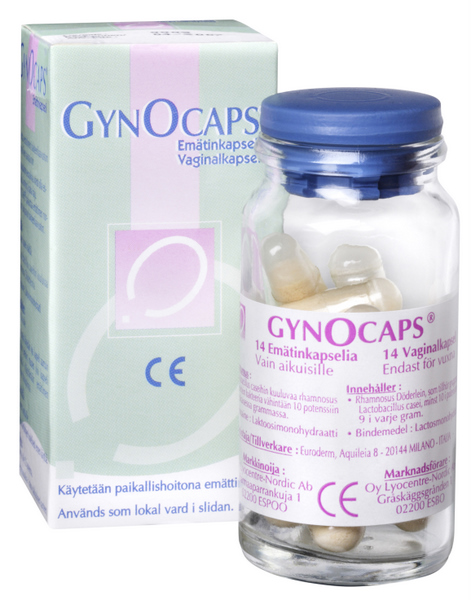 Verzoek om een prejudiciële beslissing Korkein hallinto-oikeus, Finland.
Verzoek om een prejudiciële beslissing Korkein hallinto-oikeus, Finland.
Geneesmiddel. Medisch hulpmiddel. EG-markering. Indeling van product. Uitlegging van richtlijn 93/42/EEG betreffende medische hulpmiddelen en richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik. Vaginaal preparaat met levende melkzuurbacteriën. Recht van bevoegde nationale instantie om een in een andere lidstaat als medisch hulpmiddel verkocht preparaat met een EG-markering in de zin van richtlijn 93/42 op basis van zijn farmacologisch, immunologisch of metabolisch effect te kwalificeren als geneesmiddel in de zin van richtlijn 2001/83.
In het licht van het bovenstaande geef ik het Hof in overweging de vragen van de Korkein hallinto-oikeus als volgt te beantwoorden:
- Richtlijn 93/42/EEG van de Raad van 14 juni 1993 betreffende medische hulpmiddelen, zoals gewijzigd, staat niet eraan in de weg dat een lidstaat een product op basis van het farmacologisch, immunologisch of metabolisch effect ervan indeelt als geneesmiddel in de zin van artikel 1, lid 2, sub b, van richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik, zoals gewijzigd, zelfs wanneer een andere lidstaat dat product als een medisch hulpmiddel in de zin van richtlijn 93/42 beschouwt.
- Artikel 18 van richtlijn 93/42 is van toepassing op een product waarop een EG-markering is aangebracht ondanks het feit dat het product niet onder die richtlijn valt. Artikel 8 van deze richtlijn kan daarentegen enkel van toepassing zijn krachtens artikel 18. Bovendien moeten de toepasselijke procedures van richtlijn 2001/83 worden gevolgd om een product dat correct is ingedeeld als geneesmiddel in plaats van als medisch hulpmiddel, in de handel te brengen.
- Wanneer sprake is van twee soortgelijke producten die dezelfde stof bevatten en dezelfde werkingsmechanismen hebben, staat het Unierecht niet eraan in de weg dat een lidstaat één product als een geneesmiddel en het andere product als een medisch hulpmiddel indeelt. Eén enkele lidstaat mag daarentegen in het geval van twee identieke producten niet één product als een geneesmiddel en het andere product als een medisch hulpmiddel indelen.
Gestelde vragen:
1. Wanneer een preparaat in een lidstaat overeenkomstig richtlijn 93/42/EEG2 is gekwalificeerd als een medisch hulpmiddel met een EG-markering in de zin van deze richtlijn, is het dan uitgesloten dat de bevoegde nationale instantie van een andere lidstaat dit preparaat op basis van het farmacologisch, immunologisch of metabolisch effect ervan kwalificeert als geneesmiddel in de zin van artikel 1, lid 2, sub b, van richtlijn 2001/83/EG?
2. Indien de eerste vraag ontkennend wordt beantwoord, kan deze bevoegde nationale instantie het preparaat alleen met inachtneming van de procedure van richtlijn 2001/83/EG als geneesmiddel kwalificeren of moet, alvorens de procedure tot kwalificatie als geneesmiddel volgens deze richtlijn wordt begonnen, de vrijwaringsprocedure van artikel 8 of de voorschriften over onrechtmatig aangebrachte EG-markeringen in de zin van artikel 18 van richtlijn 93/42/EEG worden gevolgd?
3. Sluiten richtlijn 2001/83/EG, richtlijn 93/42/EEG of andere bepalingen van Unierecht (met name inzake de bescherming van de gezondheid en het leven van de mens en de consumentenbescherming) uit dat preparaten met hetzelfde bestanddeel en hetzelfde effect op het grondgebied van één en dezelfde lidstaat op de markt zijn enerzijds als geneesmiddel in de zin van richtlijn 2001/83/EG, die een vergunning voor het in de handel brengen vereist, en anderzijds als medisch hulpmiddel in de zin van richtlijn 93/42/EEG?
.gif)
 2. Is Souvenaid volgens u een geneesmiddel of een dieetdrankje? Kunt u uw antwoord toelichten?
2. Is Souvenaid volgens u een geneesmiddel of een dieetdrankje? Kunt u uw antwoord toelichten? IPKat bericht: It seems obvious, really. If pharma companies are so concerned about people buying counterfeit versions of their drugs online, why don't they make it easier for these good and vulnerable folk to buy the genuine product directly from them? In this guest post, Miri Frankel reviews this line of thought in the light of a recent initiative aimed at just that purpose. Miri writes:
IPKat bericht: It seems obvious, really. If pharma companies are so concerned about people buying counterfeit versions of their drugs online, why don't they make it easier for these good and vulnerable folk to buy the genuine product directly from them? In this guest post, Miri Frankel reviews this line of thought in the light of a recent initiative aimed at just that purpose. Miri writes:
 Art. 16 Gedragscode Geneesmiddelenreclame. Onderzoek met geneesmiddelen, tenzij WMO van toepassing. Studie naar de evaluatie van de tevredenheid over het gebruik van [A] bij patiënten in het [ziekenhuis B] in Rotterdam.
Art. 16 Gedragscode Geneesmiddelenreclame. Onderzoek met geneesmiddelen, tenzij WMO van toepassing. Studie naar de evaluatie van de tevredenheid over het gebruik van [A] bij patiënten in het [ziekenhuis B] in Rotterdam. In 't kort: Prejudiciële vragen. Geneesmiddelen. Sondevoeding. Het Hof heeft geoordeeld dat vijf verschillende soorten sondevoeding moeten worden aangemerkt als 'andere alcoholvrije dranken'. Voorts heeft zij geoordeeld dat deze producten niet kunnen worden ingedeeld onder post 3004 van de GN. De Hoge Raad verzoekt het Hof van Justitie van de Europese Unie uitspraak te doen over de volgende twee vragen:
In 't kort: Prejudiciële vragen. Geneesmiddelen. Sondevoeding. Het Hof heeft geoordeeld dat vijf verschillende soorten sondevoeding moeten worden aangemerkt als 'andere alcoholvrije dranken'. Voorts heeft zij geoordeeld dat deze producten niet kunnen worden ingedeeld onder post 3004 van de GN. De Hoge Raad verzoekt het Hof van Justitie van de Europese Unie uitspraak te doen over de volgende twee vragen: In 2004 traden nieuwe lidstaten, waarin octrooirechten op farmaceutische producten niet toegestaan waren, toe tot de Europese Unie. Zulke octrooien werden in 2004 wel toegestaan, maar er zijn een aantal gevallen waarin wel een ABC (Aanvullend Beschermingscertificaat) was gegeven in een andere lidstaat voor een farmaceutisch product gedurende de tijd dat er geen bescherming was in één of meerdere (nieuwe) lidstaten. Hiervoor is een speciale afwijking van de normale regels van vrij verkeer opgenomen in de toetredingsverdragen met de nieuwe lidstaten. Deze afwijking staat bekend als de 'Specific Mechanism:
In 2004 traden nieuwe lidstaten, waarin octrooirechten op farmaceutische producten niet toegestaan waren, toe tot de Europese Unie. Zulke octrooien werden in 2004 wel toegestaan, maar er zijn een aantal gevallen waarin wel een ABC (Aanvullend Beschermingscertificaat) was gegeven in een andere lidstaat voor een farmaceutisch product gedurende de tijd dat er geen bescherming was in één of meerdere (nieuwe) lidstaten. Hiervoor is een speciale afwijking van de normale regels van vrij verkeer opgenomen in de toetredingsverdragen met de nieuwe lidstaten. Deze afwijking staat bekend als de 'Specific Mechanism: Geneesmiddelen. Richtlijn 2004/27/EG van 31 maart 2004 tot wijziging van richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik.
Geneesmiddelen. Richtlijn 2004/27/EG van 31 maart 2004 tot wijziging van richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik.















