HvJ EU: Software is een medisch hulpmiddel, zelfs indien dergelijke software geen rechtstreekse uitwerking in of op het menselijk lichaam heeft

HvJ EU 7 december 2017, LS&R 1547; IT 2439; ECLI:EU:C:2017:947; C‑329/16 (Snitem et Philips France) Prejudiciële verwijzing – Medische hulpmiddelen – Richtlijn 93/42/EEG – Werkingssfeer – Begrip „medisch hulpmiddel” – CE-markering – Nationale wetgeving die ter ondersteuning bij het voorschrijven van geneesmiddelen dienende software onderwerpt aan een door een nationale autoriteit vastgestelde certificeringsprocedure. HvJ EU:
Artikel 1, lid 1, en artikel 1, lid 2, onder a), van richtlijn 93/42/EEG van de Raad van 14 juni 1993 betreffende medische hulpmiddelen, zoals gewijzigd bij richtlijn 2007/47/EG van het Europees Parlement en de Raad van 5 september 2007, dienen aldus te worden uitgelegd dat software die een functionaliteit bevat waarmee de persoonlijke gegevens van een patiënt kunnen worden gebruikt, meer bepaald voor het opsporen van contra-indicaties, wisselwerkingen tussen geneesmiddelen en te hoge voorgeschreven doses, een medisch hulpmiddel in de zin van die bepalingen is wat deze functionaliteit betreft, zelfs indien dergelijke software geen rechtstreekse uitwerking in of op het menselijk lichaam heeft.
Bevoegde autoriteit is niet bevoegd om de aanvangsdatum van de periode van gegevensbescherming van het referentiegeneesmiddel eenzijdig te onderzoeken
Conclusie AG 7 december 2017, LS&R 1546; ECLI:EU:C:2017:957; C-557/16 (Astellas Pharma tegen Helm) Geneesmiddelen voor menselijk gebruik – Vergunning voor het in de handel brengen van een geneesmiddel dat generiek is ten opzichte van een referentiegeneesmiddel – Gedecentraliseerde procedure – Bevoegdheden van de bevoegde autoriteit van de betrokken lidstaat – Rechterlijke toetsing – Bepaling van de periode van gegevensbescherming. Conclusie AG: 1) Artikel 28, lid 5, en artikel 29, lid 1, van richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik (PB 2001, L 311, blz. 67) moeten aldus worden uitgelegd dat de bevoegde autoriteit van de betrokken lidstaat in het kader van een gedecentraliseerde procedure voor het verlenen van een vergunning voor het in de handel brengen van een generiek geneesmiddel niet bevoegd is om bij de afgifte van de nationale vergunning voor het in de handel brengen overeenkomstig artikel 28, lid 5, van richtlijn 2001/83 de aanvangsdatum van de periode van gegevensbescherming van het referentiegeneesmiddel eenzijdig te onderzoeken. Die autoriteit neemt evenwel deel aan die beoordeling in een eerder stadium van de gedecentraliseerde procedure bedoeld in artikel 28, leden 3 en 4, van richtlijn 2001/83. Door deelname van de bevoegde autoriteit van de betrokken lidstaat aan het goedkeuringsproces wordt die autoriteit derhalve medeverantwoordelijk voor de in die procedure goedgekeurde documenten. 2) De rechter van de betrokken lidstaat is in het kader van een beroep dat is ingesteld door de houder van de vergunning voor het in de handel brengen van het referentiegeneesmiddel, bevoegd om een door de bevoegde autoriteit van dezelfde betrokken lidstaat gedane vaststelling met betrekking tot de aanvangsdatum van de periode van gegevensbescherming te toetsen. Die nationale rechter is echter niet bevoegd om de rechtmatigheid van de in een andere lidstaat verleende oorspronkelijke vergunning voor het in de handel brengen te toetsen, aangezien de rechtmatigheid ervan, mede in het licht van richtlijn 2001/83, moet worden beoordeeld in de lidstaat die die oorspronkelijke vergunning voor het in de handel brengen heeft afgegeven.
HvJ EU: einde-procedure-bericht is niet gelijkwaardig aan een ABC-vergunning

HvJ EU 7 december 2017, IEF 17350; LS&R 1545; IEFbe 2427; ECLI:EU:C:2017:948; C- 567/16 (MSD tegen Comptroller General of Patents, Designs and Trade Marks). Octrooirecht. Geneesmiddelen. ABC. De ABC-verordening moet zo worden uitgelegd dat een einde-procedure-bericht dat door de referentielidstaat is opgesteld vóór het vervallen van het in de ABC-verordening bedoelde basisoctrooi, niet als gelijkwaardig kan worden beschouwd aan een vergunning voor het in de handel brengen in de zin van eerstgenoemde bepaling, zodat geen ABC kan worden verkregen op basis van een dergelijk bericht.
Antwoord HvJ EU:
1) Artikel 3, onder b), van verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen moet in die zin worden uitgelegd dat een einde-procedure-bericht dat door de referentielidstaat overeenkomstig artikel 28, lid 4, van richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik, zoals gewijzigd, wat de geneesmiddelenbewaking betreft, bij richtlijn 2010/84/EU van het Europees Parlement en de Raad van 15 december 2010, is opgesteld vóór het vervallen van het in artikel 1, onder c), van verordening nr. 469/2009 bedoelde basisoctrooi, niet als gelijkwaardig kan worden beschouwd aan een vergunning voor het in de handel brengen in de zin van eerstgenoemde bepaling, zodat geen aanvullend beschermingscertificaat kan worden verkregen op basis van een dergelijk bericht.
Uitspraak ingezonden door Marleen van den Horst en Jaap Bremer, BarentsKrans; Julian Eck, Mark van Gardingen en Jan Pot, Brinkhof; Ricardo Dijkstra, Vondst advocaten.
Gelet op bodembeslissingen van ervaren collega octrooi-instanties kan behoorlijk worden getwijfeld over de geldigheid

Vzr. Rechtbank Den Haag 5 december 2017, IEF 17330; LS&R 1544; ECLI:NL:RBDHA:2017:14319 (Icos tegen Teva; Sandoz en Mylan). Octrooirecht. Provisionele voorziening. Icos vordert zonder succes provisionele voorziening tot staking van inbreuk op EP 1 173 181 B3 voor de duur van de onderhavige kort gedingen ex 223 Rv. In het VK en Duitsland hebben generieke producenten van tadalafil 'clear the way' procedures gevoerd, het Engelse en Duitse deel van EP 181 zijn nietig bevonden. Gelet op deze bodembeslissingen van ervaren collega octrooi-instanties, alsmede gelet op het feit dat Daugan ook in de onderhavige kort gedingen en in de na te noemen VRO-nietigheidsprocedure ten grondslag is gelegd aan de inventiviteitsaanval, kan ten minste behoorlijk worden getwijfeld over de geldigheid van het Nederlandse deel van het octrooi zodat het opleggen van een provisioneel verbod niet opportuun is. Vorderingen worden afgewezen, aanhouding tot eindvonnis in de meervoudige bodemprocedure tegen TEVA Pharmaceuticals, waarin pleidooi gepland staat op 22 december.
Uitspraak ingezonden door Tjerk Sigterman, Otto Swens, Ricardo Dijkstra, Vondst Advocaten
Voeging van niet-VRO-zaak met VRO-zaak is ontoelaatbaar

Rechtbank Den Haag 22 november 2017, IEF 17320; LS&R 1543 (AstraZeneca tegen Sandoz). Octrooirecht. Voeging. Schorsing. Vervolg op het kort geding [IEF 16152], waarin Sandoz een voorlopig verbod tot inbreuk op EP 1 250 138 is opgelegd. Vervolgens heeft Sandoz een (VRO-)nietigheidsprocedure aanhangig gemaakt en AstraZeneca (vervolgens) een (gewone) bodemzaak waarin zij een definitief verbod vordert. Sandoz verzoekt schorsing bodemzaak vanwege de reeds aangespannen nietigheidsprocedure. Astrazeneca vordert voeging of informele rolvoeging van beide zaken. Voeging van een niet-VRO-(bodem)zaak met een VRO-(nietigheids)zaak leidt ertoe dat de eerste zaak feitelijk ook onder dat regime zou komen te vallen, zonder dat de eisende partij daartoe heeft verzocht. Dit is niet toelaatbaar. Het verzoek tot schorsing van de bodemzaak wordt wel toegewezen. Het belang aan de (gewone) bodemzaak vervalt als in de nietigheidsprocedure ofwel de nietigheidsvordering van Sandoz wordt toegewezen, of de in reconventie door AstraZeneca gevorderde (definitieve) verbodsvorderingen worden toegewezen. De vertraging die schorsing met zich meebrengt is proceseconomisch aanvaardbaar indien die schorsing duurt totdat er in de nietigheidsprocedure eindvonnis (voorjaar 2018) is gewezen. Schorsing tot het vonnis in de nietigheidsprocedure in kracht gewijsde is gegaan is niet aanvaardbaar.
EPLaw - Board Changes, Young EPLAW, Report on UPC Progress and Comparative Patent Litigation Practice
Uit het persbericht: UK – the parliamentary process is expected to be completed in the coming weeks, so that the ratification instrument could be lodged early next year. UK ratification will permit work to begin on amendments of the UPC Agreement and Rules of Procedure to accommodate the UK’s continuing role in the new system after Brexit.
Germany – a complaint is pending before the Constitutional court, halting the process of ratification. EPLAW has responded to a request from the Court to file submissions and has provided background context to the issues raised. Timing for conclusion of the proceedings is unknown. In the meantime, the start of the UPC / unitary patent system is delayed pending German ratification.
Geen seksueel contact, maar wel sprake van te vergaand privé-contact tussen patiënt en verpleegkundige
Regionaal Tuchtcollege voor de Gezondheidszorg Eindhoven 31 juli 2017, LS&R 1541; ECLI:NL:TGZREIN:2017:121 (Inspectie Gezondheidszorg en Jeugd tegen Verpleegkundige). Inspectie voor de Gezondheidszorg. Seksueel grensoverschrijdend gedrag. De verpleegkundige is, geleid door zijn affectieve gevoelens, gedurende circa één jaar het (privé)leven van de psychisch kwetsbare patiënte binnengedrongen ter vervulling van eigen behoeften, wensen en gevoelens. Initiatief kwam steeds van de verpleegkundige. Zijn rol was voor patiënte volstrekt onduidelijk en onprofessioneel. Na beëindiging van de behandelrelatie voortzetting van de contacten op eenzelfde, indringende en ongeoorloofde wijze. De meerdere (onnodige) aanrakingen moeten vanuit de intentie van verweerder als seksueel getint worden geacht. Niet zelf tot het inzicht gekomen dat hij zijn professionele grenzen heeft overschreden. Doorhaling van zijn inschrijving in het BIG-register.
Conclusie AG: In het kader van het gezichtspunt van de uitvindingsgedachte mee laten wegen of er een intentie was om de beschermingsomvang te beperken
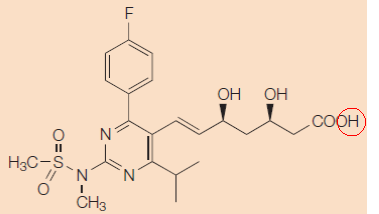
Conclusie AG HR 24 november 2017, IEF 17302; LS&R 1540; ECLI:NL:PHR:2017:1282 (Resolution tegen AstraZeneca-Shionogi) Octrooirecht. Beschermingsomvang. Het “eigen lexicon”-problematiek; rol uitvindingsgedachte als gezichtspunt. Afstandsleer. Toegevoegde materie. In deze octrooizaak over de beschermingsomvang van EP 471 (voor een nieuwe cholesterolremmer) is de vraag of sprake is van een beperkende definitie (“eigen lexicon”) in de beschrijving van het conclusiekenmerk “farmaceutisch aanvaardbaar zout”. Het hof oordeelt [IEF 15698], anders dan de rechtbank [IEF 15120], na een uitvoerige motivering dat de gemiddelde vakman de in paragraaf 7 van de beschrijving gegeven definitie niet limitatief zal opvatten. De cassatieklachten hierover, samengevat inhoudende dat deze uitleg onbegrijpelijk is en in strijd met art. 69 EOV, zie ik niet opgaan. Ik concludeer dan ook tot verwerping van het cassatieberoep.
Vertaling van deze uitspraak ingezonden door Tobias Cohen Jehoram, Vivien Rörsch en Carlos van Staveren, De Brauw Blackstone Westbroek.
Supreme Court of the Netherlands MSD/Teva Pharma (english translation)

Supreme Court of the Netherlands 3 November 2017, IEF 17300; LS&R 1539 (Merck Sharp & Dohme v. Teva Pharma and Pharmachemie; English translation of IEF 17241) Patent. Swiss-type claim. Classic second medical indication.
3.5 Against the background of all of the foregoing factors, cassation grounds 1.1, 1.2 and 1.3 correctly complain that the distinction drawn by the Appellate Court in the scope of protection of patents for the 'classic second medical indication' and the 'sub-group indication', mentioned at 4.2 of the contested judgment, is an incorrect distinction. As follows from the deliberations at 3.4.4 above, it is necessary in all cases of Swiss-type claims for (direct) infringement, and also sufficient, that the average person skilled in the art will consider that the substance is (also) intended for or suited to the treatment covered by the second medical indication patent, that the manufacturer or seller foresees or ought to foresee that the generic drug he manufactures or offers will intentionally be used for that treatment and that he does not take the steps specified above in 3.4.4. There is no place in the system of the EPC for a categorical distinction between the two types of second medical indications, introduced in abstracto, as done by the Appellate Court at the end of 4.4 – in relation to the specifically indicated use. The remaining complaints in cassation ground 1 require no discussion. The same applies to cassation ground 2.
Kamerstuk: Maak gebruik van wettelijke instrumenten, zoals dwanglicenties, importvergunning, stimulering van apothekersbereiding

Brief regering 16 november 2017, Geneesmiddelenbeleid, Kamerstukken II 2017-2018, 29 477, nr. 453. Geneesmiddelenontwikkeling duurt vaak lang en is complex. Er zijn veel actoren, ingewikkelde Europese regelgeving en een grote faalkans. Bij succes wordt er aan het eind van de rit steeds vaker een duur geneesmiddel op de markt gebracht, meestal door de grote farmaceutische industrie. Nederlandse academische en private partijen spelen een rol in dat ontwikkelproces. Steeds vaker nemen deze partijen ook initiatieven om het proces anders in te richten. In dat licht vroeg de vorige minister in 2016 aan de Raad voor Volksgezondheid en Samenleving om met vernieuwende inzichten te komen en om oplossingen aan te dragen. «Hoe kan de ontwikkeling van nieuwe geneesmiddelen doelmatiger, waarbij bereikte efficiencyverbeteringen resulteren in lagere prijzen of anderszins ten goede komen aan de samenleving?» Op 9 november jongsleden ontving de huidige minister het advies van de Raad.

















