Indeling in douanesysteem van papier met biochemische reactie
HvJ EU 11 september 2013, zaak C-541/13 (Douane Advies Bureau Rietveld) Prejudiciële vragen: Verzoeker en verweerder (douanekantoor Hannover) zijn het oneens over de indeling in het douanesysteem van twee producten. Het eerste is genaamd ‘WarmMark’ en is een temperatuurindicator voor eenmalig gebruik, bijvoorbeeld bij transporten van gevaarlijke goederen. Het gaat om papierstroken die op de goederen geplakt worden. Tussen de papierstroken, waarvan één met rode vloeistof doordrenkt, zit een folie die alvorens de stroken hun werk kunnen doen ertussenuit getrokken moet worden. In geval van (over)verhitting zorgt capillaire werking er verder voor dat een waarschuwingssysteem in werking treedt: het papier kleurt dan rood.
Prejudiciële vragen: Verzoeker en verweerder (douanekantoor Hannover) zijn het oneens over de indeling in het douanesysteem van twee producten. Het eerste is genaamd ‘WarmMark’ en is een temperatuurindicator voor eenmalig gebruik, bijvoorbeeld bij transporten van gevaarlijke goederen. Het gaat om papierstroken die op de goederen geplakt worden. Tussen de papierstroken, waarvan één met rode vloeistof doordrenkt, zit een folie die alvorens de stroken hun werk kunnen doen ertussenuit getrokken moet worden. In geval van (over)verhitting zorgt capillaire werking er verder voor dat een waarschuwingssysteem in werking treedt: het papier kleurt dan rood.
Het tweede product is ‘ColdmarK® Freeze Indicator’. Eveneens een eenmalig te gebruiken indicator die door kleurverandering temperatuurwijzigingen aangeeft, te gebruiken bij controle van opslag- en transporttemperatuur. Ook dit werkt volgens een systeem van onomkeerbare verkleuring van een vloeistof als de temperatuur van de goederen daar aanleiding toe geeft.
Voor beide producten heeft verzoeker bij verweerder een BTI aangevraagd. Hij overlegt daarbij een brief van de VS-douaneAut uit maart 2010 waaruit blijkt dat de goederen daar zijn ingedeeld onder tariefpost 3822 00 5090 en waarin wordt uiteengezet waarom de goederen niet onder tariefpost 9025 zouden moeten komen.
Verweerder deelt te goederen echter in onder 3824 9097 99 = “bereiding van de chemische industrie, elders genoemd noch elders onder begrepen”. Verzoeker maakt bezwaar maar dat wordt afgewezen omdat voor de door verzoeker gewenste indeling is vereist dat bij het gebruik van de goederen een chemische of biochemische reactie plaatsvindt. De verkleuringen zijn echter reacties op fysische processen. De ruimere opvatting van de VS-douaneAut van het begrip ‘reageermiddelen’ is voor de indeling door de EU-douaneAut niet relevant.
Verzoeker gaat in beroep. Hij meent dat het voor een indeling onder het door hem gewenste postnummer niet noodzakelijk is dat sprake is van een (bio-)chemische reactie omdat dit niet als vereiste in de omschrijving van het postnummer voorkomt.
Volgens de verwijzende Duits rechter (Finanzgericht Hamburg) is de beslissende vraag of de werking van de betreffende stoffen overeenkomstig de toelichting op GS-post 3822, punt 02.0, tweede zin, dient te berusten op meetbare of waarneembare veranderingen van de biologische of chemische stoffen waaruit een reageermiddel van GN-post 3822 bestaat. Aangezien het begrip ‘reageermiddel’ niet nader wordt gepreciseerd stelt hij het HvJEU de volgende vraag:
“Dient het in GN-post 3822 in de omschrijving “reageermiddelen [...] voor diagnose of voor laboratoriumgebruik” gebruikte begrip “reageermiddel” aldus worden opgevat dat het daarbij moet gaan om een substantie die ertoe dient, door het ondergaan van een chemische verandering als gevolg van een chemische reactie op, of met, een te onderzoeken stof, een toestand of eigenschap van deze stof aan te tonen?”
Aansprakelijkheid; kosten voorlopig getuigenverhoor niet begroot
Rechtbank Arnhem 10 februari 2012, ECLI:NL:RBARN:2012:3818 (platvoetstand en vaatzenuwstreng)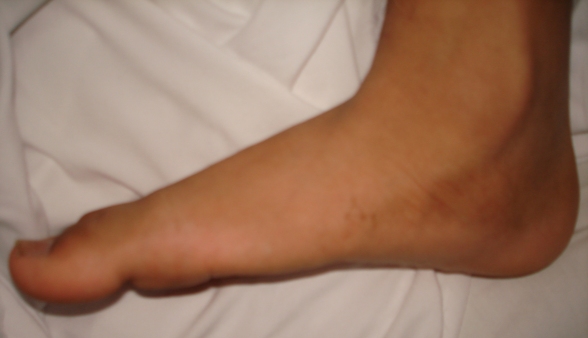 Deelgeschil. Medische aansprakelijkheid. Afwijzing op grond van artikel 1019z. Deskundigenberichten ingetrokken en geblokkeerd. Kosten voor voorlopig getuigenverhoor niet begroot.
Deelgeschil. Medische aansprakelijkheid. Afwijzing op grond van artikel 1019z. Deskundigenberichten ingetrokken en geblokkeerd. Kosten voor voorlopig getuigenverhoor niet begroot.
Op 9 november 2001 is[verzoekster] door orthopedisch chirurg [verweerder 1] in de kliniek die de stichting exploiteert geopereerd aan haar rechtervoet, die een platvoetstand vertoonde. Bij de operatie, waarbij het hielbeen moest worden doorgezaagd, heeft [verweerder 1] onbedoeld de direct achter het hielbeen gelegen vaatzenuwstreng doorgenomen.
3.6. Bij de beoordeling in het kader van artikel 1019z Rv zal de investering in tijd, geld en moeite die met de deelgeschilprocedure gepaard gaan moeten worden afgewogen tegen het belang van de vordering en de bijdrage die een beslissing aan de totstandkoming van een minnelijke regeling kan leveren.
Versantvoort heeft ter zitting al te kennen gegeven dat volgens haar in Nederland geen onafhankelijke deskundige kan worden gevonden. Afgezien daarvan is tussen partijen bepaald niet uitgekristalliseerd wat de gevolgen moeten zijn van de blokkering van het rapport van Verhaar, welke blokkering is geschied niet zozeer uit een oogpunt van privacy als wel omdat[verzoekster] van mening was dat de deskundige niet (meer) met de vereiste onafhankelijkheid kon rapporteren. De rechtbank is van oordeel dat onder deze omstandigheden nadere instructie het bestek van een deelgeschil te buiten gaat. De te vergen tijd en energie staan naar het oordeel van de rechtbank niet in verhouding tot de kans dat een vaststellingsovereenkomst tot stand komt. Het verzoek stuit daarom af op artikel 1019z Rv.
2.1.
Op 9 november 2001 is[verzoekster] door orthopedisch chirurg [verweerder 1] in de kliniek die de stichting exploiteert geopereerd aan haar rechtervoet, die een platvoetstand vertoonde. Bij de operatie, waarbij het hielbeen moest worden doorgezaagd, heeft [verweerder 1] onbedoeld de direct achter het hielbeen gelegen vaatzenuwstreng doorgenomen.[verzoekster] ervaart na de operatie een beperkte belastbaarheid van de rechtervoet. Zij heeft veel pijn, ook in rust, een erg koude voet, en kan niet veel lopen, aldus[verzoekster].
2.2.
Versantvoort houdt [verweerder 1] en de stichting aansprakelijk voor de letselschade die zij als gevolg van het doornemen van de vaatzenuwstreng lijdt. De schade is onder meer erin gelegen dat[verzoekster], die met haar echtgenoot een horecaonderneming drijft, vanwege de beperkingen die zij bij het lopen ondervindt extra personeelskosten moet maken. [verweerder 1] en de stichting wijzen aansprakelijkheid van de hand.
(...)
3.6.
Bij de beoordeling in het kader van artikel 1019z Rv zal de investering in tijd, geld en moeite die met de deelgeschilprocedure gepaard gaan moeten worden afgewogen tegen het belang van de vordering en de bijdrage die een beslissing aan de totstandkoming van een minnelijke regeling kan leveren.
Versantvoort heeft ter zitting al te kennen gegeven dat volgens haar in Nederland geen onafhankelijke deskundige kan worden gevonden. Afgezien daarvan is tussen partijen bepaald niet uitgekristalliseerd wat de gevolgen moeten zijn van de blokkering van het rapport van Verhaar, welke blokkering is geschied niet zozeer uit een oogpunt van privacy als wel omdat[verzoekster] van mening was dat de deskundige niet (meer) met de vereiste onafhankelijkheid kon rapporteren. De rechtbank is van oordeel dat onder deze omstandigheden nadere instructie het bestek van een deelgeschil te buiten gaat. De te vergen tijd en energie staan naar het oordeel van de rechtbank niet in verhouding tot de kans dat een vaststellingsovereenkomst tot stand komt. Het verzoek stuit daarom af op artikel 1019z Rv.
3.7.
Ter zake van de kosten geldt het volgende.
Begroot dienen te worden de kosten bij de behandeling van het verzoek aan de zijde van[verzoekster] (artikel 1019aa Rv). Het getuigenverhoor heeft niet plaatsgevonden in de onderhavige procedure, maar in de procedure strekkende tot het bevelen van een voorlopig getuigenverhoor. De kosten van[verzoekster] bij de behandeling van deze laatste procedure komen daarom niet op de voet van artikel 1019aa Rv voor begroting in aanmerking. Dit oordeel ligt ook in de rede nu de noodzaak van een getuigenverhoor in de deelgeschilprocedure zelf in het algemeen leidt tot afwijzing van het verzoek op de voet van artikel 1019z Rv. Blijkens het verzoekschrift heeft de advocaat van[verzoekster] 13,5 uur aan het voorlopig getuigenverhoor besteed. De kosten van deze uren zullen derhalve niet worden begroot.
Tweede evaluatie wet op beroepen in individuele gezondheidszorg
Tweede evaluatie Wet op de beroepen in de individuele gezondheidszorg, Bijlage bij Kamerstukken II 29 292, nr. 182. Wetten worden periodiek geëvalueerd om na te gaan of de doelen die ermee worden beoogd ook werkelijk worden bereikt en of na een aantal jaren de wereld niet zo is veranderd dat aanpassingen noodzakelijk zijn. De evaluaties zoals die onder regie van ZonMw en zijn Commissie evaluatie regelgeving worden uitgevoerd dragen ertoe bij dat wet- en regelgeving gebaseerd is op rationele overwegingen en niet alleen op politieke ideologie.
Wetten worden periodiek geëvalueerd om na te gaan of de doelen die ermee worden beoogd ook werkelijk worden bereikt en of na een aantal jaren de wereld niet zo is veranderd dat aanpassingen noodzakelijk zijn. De evaluaties zoals die onder regie van ZonMw en zijn Commissie evaluatie regelgeving worden uitgevoerd dragen ertoe bij dat wet- en regelgeving gebaseerd is op rationele overwegingen en niet alleen op politieke ideologie.
In de Wet op de beroepen in de individuele gezondheidszorg worden zaken geregeld zoals titels en de bescherming ervan, opleidingen, de handelingen die ‘voorbehouden’ zijn aan bepaalde professionals en de tuchtrechtspraak. Na een eerste evaluatie van de wet in 2002, was het tijd opnieuw te bezien of de wet nog voldoende doeltreffend en toekomstbestendig is. Een aantal akelige incidenten in de afgelopen jaren vormde een aanleiding tot deze tweede evaluatie.
De commissie die de multidisciplinaire projectgroep heeft begeleid, is van oordeel dat de onderzoekers hun opdracht op voortreffelijke wijze hebben vervuld. Het degelijke werk dat voor u ligt, is daarvan het bewijs. Een woord van dank is op zijn plaats aan de secretaris en de leden van de begeleidingscommissie die met hun kritische commentaar aanzienlijk hebben bijgedragen tot de kwaliteit van het resultaat.
Het rapport mondt uit in een aantal weloverwogen aanbevelingen. Het is te hopen dat de wetgever deze serieus in zijn overwegingen betrekt wanneer de wet wordt herzien.
Wet verhoging minimumleeftijd verkoop tabaksproducten aanvaard
 Uit het persbericht: De Eerste Kamer heeft op dinsdag 12 november de Wet verhoging minimumleeftijd verkoop tabaksproducten aanvaard. Dit voorstel verhoogt de minimumleeftijd van jongeren aan wie tabaksproducten mogen worden verkocht van 16 naar 18 jaar. De fracties van de VVD, PvdA, CDA, CU, SP, PvdD, OSF, 50PLUS, SGP stemden voor. De fracties van de PVV en D66 stemden tegen.
Uit het persbericht: De Eerste Kamer heeft op dinsdag 12 november de Wet verhoging minimumleeftijd verkoop tabaksproducten aanvaard. Dit voorstel verhoogt de minimumleeftijd van jongeren aan wie tabaksproducten mogen worden verkocht van 16 naar 18 jaar. De fracties van de VVD, PvdA, CDA, CU, SP, PvdD, OSF, 50PLUS, SGP stemden voor. De fracties van de PVV en D66 stemden tegen.
De huidige Tabakswet kent een minimumleeftijd van zestien jaar voor de verkoop van tabaksproducten. De verhoging van deze leeftijdsgrens houdt verband met de aanstaande verhoging van de leeftijdsgrens voor de verkoop van alcohol. Die wordt in 2014 wettelijk van kracht als gevolg van het aanvaarden van het initiatiefwetsvoorstel van de Tweede Kamerleden Voordewind, Van der Staaij, Hilkens en Bruins Slot tot verhoging van de leeftijdsgrens voor alcohol. Er komt dus één heldere leeftijdsgrens voor tabak en alcohol: geen alcohol en niet roken onder de 18.
Inmiddels hanteren 22 van de 27 EU landen een leeftijdgrens van 18 jaar voor de verkrijgbaarheid van tabaksproducten. Wereldwijd loopt de leeftijdsgrens voor tabak uiteen van 15 tot 21. De tendens is dat steeds meer landen de leeftijdsgrens verhogen.
Uitleg van de termen kortingen en bonus aan zorgprofessional
Codecommissie Gedragscode Medische Hulpmiddelen 14 november 2013, Advies A 13.08 (Kortingen) Aanvrager is een farmaceutisch bedrijf dat medische hulpmiddelen verkoopt. Zij wenst aan bepaalde afnemers (drogisterijen) onder bepaalde voorwaarden bonussen te verstrekken. Zo kan een bonus worden verkregen in het geval een drogist bepaalde promotionele activiteiten verricht, zoals het plaatsen van een bepaald medisch hulpmiddel op een bepaalde hoogte in het schap. Ook kan een bonus worden verkregen indien een bepaald medisch hulpmiddel door de drogist meer wordt ingekocht dan voorheen, oftewel indien er groei is in het aantal ingekochte medische hulpmiddelen.
Aanvrager is een farmaceutisch bedrijf dat medische hulpmiddelen verkoopt. Zij wenst aan bepaalde afnemers (drogisterijen) onder bepaalde voorwaarden bonussen te verstrekken. Zo kan een bonus worden verkregen in het geval een drogist bepaalde promotionele activiteiten verricht, zoals het plaatsen van een bepaald medisch hulpmiddel op een bepaalde hoogte in het schap. Ook kan een bonus worden verkregen indien een bepaald medisch hulpmiddel door de drogist meer wordt ingekocht dan voorheen, oftewel indien er groei is in het aantal ingekochte medische hulpmiddelen.
Vragen:
1) Dient men sub a van art. 6 GMH zo te lezen, dat enkel ‘kortingen’ zijn toegestaan, in de zin van een mindering op de prijs die de zorgprofessional betaalt voor de medische hulpmiddelen?
2) Is het toegestaan om in het kader van een handelstransactie een ‘bonus’ te verstrekken, in de zin van een vast bedrag dat wordt uitgekeerd indien de zorgprofessional aan bepaalde voorwaarden voldoet, zonder dat er sprake is van een mindering op de prijs of verrekening anderszins? Daarbij staan kennelijk twee situaties ter beoordeling:
a. Koppeling van een bonus (in de vorm van een vast bedrag dan wel een percentage) aan een door de drogist te verrichten promotionele activiteit? Te denken valt volgens aanvrager aan het plaatsen van een reclamezuil of het positioneren van een medisch hulpmiddel op een bepaalde aansluitende afstand in het schap.
b. Koppeling van een bonus (in de vorm van een percentage) aan de toename van het aantal inkopen door de drogist van een bepaald medisch hulpmiddel.
Beoordeling:
Blijkens artikel 6 GMH lid 2 zijn bonussen en kortingen toegestaan, mits (voor zover in het kader van dit advies van belang):
a. sprake is van kortingen in geld of van kortingen in natura (waarbij die kortingen in natura branche-gerelateerde producten moeten betreffen);
b. de kortingen (in geld of in natura) uitdrukkelijk schriftelijk tot uitdrukking zijn gebracht.
Blijkens de adviesaanvraag kan het daarbij meer specifiek gaan om twee situaties:
a. een bonus voor een specifieke door de drogist te verrichten promotionele activiteit, of
b. een bonus wanneer er (omzet)groei optreedt - en er dus meer wordt besteld -.
De situatie onder b. is wel een situatie waarin art. 6 GMH kan worden toegepast, mits aan de eisen van dat artikel wordt voldaan. De voorzitter merkt daarbij op dat het in het handelsverkeer normaal is dat er meer voordeel kan worden behaald indien er meer wordt omgezet en dus ingekocht.
De voorzitter constateert dat de uitkomst ten aanzien van situatie a. op het eerste gezicht opvallend – en mogelijk ook onwenselijk - lijkt in een markt waarin het besluit tot aanschaf en gebruik volledig wordt genomen door de eindgebruiker/consument zelf. De tekst van de GMH bevat echter geen aanknopingspunt om een onderscheid te maken tussen (afspraken tussen leveranciers en bepaalde zorgprofessionals met betrekking tot) enerzijds medische hulpmiddelen waarbij de consument zelf volledig een beslissing neemt tot aankoop en gebruik, en anderzijds medische hulpmiddelen bij de keuze waarvan een zorgprofessional een rol speelt.
Op grond van art. 6 GMH is er geen bezwaar om bonussen en kortingen te verlenen in diverse vormen, zoals een percentage of een vast bedrag, mits aan de eisen van dit artikel wordt voldaan. Een korting of bonus die afhankelijk is van het aantal door de zorgprofessional afgenomen hulpmiddelen, is een korting die past in het kader van art. 6 GMH.
Wijziging Geneesmiddelenwet op komst
A. Kooy, Wijziging Geneesmiddelenwet op komst, LS&R 763.
 Een redactionele bijdrage van Annemieke Kooy, Axon Advocaten.
Een redactionele bijdrage van Annemieke Kooy, Axon Advocaten.
De Europese richtlijn betreffende vervalste geneesmiddelen wordt geïmplementeerd: meer regels, vaker registraties nodig. Voor wat en voor wie?
Inleiding: De distributie van geneesmiddelen in Europa gaat volgens een gesloten systeem, zodat er een legale distributieketen is. Pas als vergunningen zijn verleend, mogen geneesmiddelen in het verkeer worden gebracht. De Nederlandse Geneesmiddelen wet zal worden gewijzigd ter implementatie van richtlijn 2011/62/EU (“Richtlijn”), die beoogt te verhinderen dat vervalste geneesmiddelen in de legale distributieketen belanden.
Wijziging Nederlandse Geneesmiddelen wet
In de gewijzigde situatie is zal sprake zijn van een uitbreiding wat betreft producten en wat betreft actoren. Als producten zullen niet alleen geneesmiddelen van belang zijn, maar ook werkzame stoffen. Nieuwe actoren zijn bemiddelaars in geneesmiddelen en groothandelaars en fabrikanten van werkzame stoffen (voorheen waren dit alleen groothandelaars en fabrikanten van geneesmiddelen). Deze moeten nu allen voorafgaand aan de productie/verhandeling van een geneesmiddel geregistreerd worden door CIBG (Farmatec).
Lees de gehele bijdrage hier.
Annemieke Kooy, Axon Advocaten
Geen declarabel consult in verband met onduidelijke praktijksituatie
Ktr. Rechtbank Noord-Holland 25 september 2013, ECLI:NL:RBNHO:2013:9339 (Fa-med B.V. tegen gedaagde) Declaratie kaakchirurg. De vordering wordt afgewezen omdat geen sprake is geweest van een declarabel consult in verband met de onduidelijke praktijksituatie van tandarts met kaakchirurg, broers van elkaar. In verband met het plaatsen van een implantaat bij [gedaagde] heeft tandarts F. Fathi voor [gedaagde] een afspraak gemaakt bij de kaakchirurg M. Fathi, een broer van de genoemde tandarts die praktijk houdt in dezelfde ruimte als de tandarts F. Fathi.
Declaratie kaakchirurg. De vordering wordt afgewezen omdat geen sprake is geweest van een declarabel consult in verband met de onduidelijke praktijksituatie van tandarts met kaakchirurg, broers van elkaar. In verband met het plaatsen van een implantaat bij [gedaagde] heeft tandarts F. Fathi voor [gedaagde] een afspraak gemaakt bij de kaakchirurg M. Fathi, een broer van de genoemde tandarts die praktijk houdt in dezelfde ruimte als de tandarts F. Fathi.
1. [gedaagde] weigert de nota van de kaakchirurg te voldoen, daartoe stellende dat de kaakchirurg geen onderzoek heeft verricht tijdens de eerste afspraak die door diens broer was gemaakt. Volgens de stelling van [gedaagde] heeft de kaakchirurg het nodige onderzoek pas bij een latere afspraak verricht, welk onderzoek ook is gefactureerd en wel is betaald.
5. De reactie van Fa-med houdt in dat de kaakchirurg op 24 maart 2012 in de mond van [gedaagde] heeft gekeken en dat er dus sprake was van een consult. Daarmee gaat Fa-med evenwel voorbij aan het op die dag werkelijk verrichte onderzoek, dat volgens [gedaagde] niet heeft plaatsgevonden. Het enkel in de mond kijken is daarvoor niet voldoende, omdat immers later bleek dat ook foto’s moesten worden en zijn bekeken en een behandelplan moest worden en is opgesteld. Uit de reactie van Fa-med en de daarin overgelegde producties blijkt niet onomstotelijk dat dit alles op 24 maart 2013 is gedaan.
6. Onder de gegeven omstandigheden komt de kantonrechter tot de conclusie dat op 24 maart 2012 geen sprake was van een (volledig) consult dat afzonderlijk in rekening kon worden gebracht. De kosten van deze afspraak moeten geacht worden te zijn gedekt door de betaling van het latere consult. Dit geldt temeer omdat de afspraak was gemaakt door de tandarts bij diens broer in dezelfde praktijkruimte en voorts gesteld noch gebleken is dat aan [gedaagde] is meegedeeld dat voor deze afspraak afzonderlijke kosten in rekening zouden worden gebracht. In beginsel is een dergelijke mededeling niet vereist, maar in dit geval wel gelet op de familierelatie tussen de tandarts en de kaakchirurg en het feit dat zij in dezelfde ruimte praktijk houden. Eén en ander kan tot een onduidelijke situatie als de onderhavige aanleiding geven. Het ligt dan op de weg van de tandarts en/of de kaakchirurg hier volledig duidelijk over te zijn.
Prejudiciële vragen over het 'specifieke mechanisme' bij inroepen ABC
Prejudiciële vragen aan HvJ EU 14 oktober 2013, zaak C-539/13 (Sigma Pharmaceuticals PLC. tegen Merck Canada Inc en Merck Sharp & Dohme Ltd) - dossier
 Prejudiciële vragen gesteld door Court of Appeal, Verenigd Koninkrijk.
Prejudiciële vragen gesteld door Court of Appeal, Verenigd Koninkrijk.
Octrooirecht. ABC. Toetredingsakte 2004. Merck verwijt Sigma inbreuk te maken op haar octrooirechten door parallelimport in het Verenigd Koninkrijk vanuit Polen van een geneesmiddel van Merck, genaamd „Singulair” (generieke naam: „montelukast”, een geneesmiddel voor de behandeling van astma). Het octrooi voor dit geneesmiddel is in oktober 2011 verstreken, maar er is een aanvullend beschermingscertificaat (ABC) geldig tot februari 2013. Sigma betwist niet dat dit ABC door Merck kon worden ingeroepen op basis van het ‘specifieke mechanisme’, een bijzondere bepaling in de Toetredingsakte van onder meer Polen (2004) op grond waarvan mag worden afgeweken van het beginsel van het vrije verkeer van goederen.
Volgens het recht van het Verenigd Koninkrijk hebben octrooihouders het recht om zich te verzetten tegen inbreuken op hun octrooirechten. Na de toetreding van de NLS in 2004 heeft de firma die in het Verenigd Koninkrijk de exclusieve rechten op het octrooi had verkregen (Merck Sharpe & Dohm, MSD) als interne beleidslijn aangenomen zich te verzetten tegen parallelimporten vanuit onder meer Polen. Het kantoor ontving zo in 2009 170 kennisgevingen van (voorgenomen) parallelimport, waaronder van Pharma, een met verweerster verbonden onderneming. Pharma meldde zich per brief bij MSD met het verzoek mede te delen of MSD zich zou verzetten tegen de door Pharma voorgenomen vergunningaanvraag, maar MSD heeft die brief, door een administratieve vergissing, nooit beantwoord, terwijl praktijk was dat zij dergelijke brieven beantwoordde met de mededeling dat zij in verzet zou komen. Latere brieven van Pharma over voorgenomen ompakking van de producten werden evenmin beantwoord, maar tegen die praktijk verzet MSD zich niet.
In december 2010 start MSD een procedure tegen Pharma nadat zij de naam Pharma XL als houder van de product licence (parallel-import) (= PL(PI)) had aangetroffen op verpakkingen van het medicijn in het Verenigd Koninkrijk. Zij eist schadevergoeding en vernietiging van de onverkochte voorraad.
Het aanvraagformulier voor een PL(PI) bevat (overeenkomstig de vereisten van het ‘specifieke mechanisme’) de verplichting voor de aanvrager om in het geval van een voorgenomen parallelimport vanuit een van de NLS te verklaren dat het ‘specifieke mechanisme’ niet van toepassing is op het betrokken product, dan wel aan te tonen dat de houder van de relevante rechten een maand van tevoren in kennis is gesteld van de voorgenomen invoer. De in het Verenigd Koninkrijk verantwoordelijke instantie ‘Medicines and Healthcare Products Regulatory Agency (MHRA verleent de PL(PI) ongeacht of het mechanisme van toepassing is en verleent dit ook bij verzet van de octrooihouder.
Het Patents County Court waar de zaak is aangebracht stelt verzoekster in het gelijk. Sigma gaat daartegen in beroep.
Prejudiciële vragen:
Toepassingsvoorwaarden voor het specifieke mechanisme
1. Kan de houder van een octrooi of een aanvullend beschermingscertificaat, of zijn begunstigde, zich enkel op zijn rechten krachtens de eerste alinea van het specifieke mechanisme beroepen indien hij vooraf zijn voornemen in die zin kenbaar heeft gemaakt?
2. Indien de eerste vraag bevestigend wordt beantwoord:
(a) Hoe moet dat voornemen kenbaar worden gemaakt?
(b) Kan de houder, of zijn begunstigde, zich nog op zijn rechten beroepen ten aanzien van de farmaceutische producten die in een lidstaat zijn ingevoerd of in de handel gebracht vóór de verklaring van zijn voornemen om die rechten in te roepen?
De kennisgever
3. Wie moet de in de tweede alinea van het specifieke (omissis) mechanisme bedoelde voorafgaande kennisgeving aan de houder van een octrooi of een aanvullend beschermingscertificaat, of zijn begunstigde, doen? In het bijzonder:
(a) Moet de voorafgaande kennisgeving worden gedaan door degene die voornemens is het farmaceutische product in te voeren of in de handel te brengen?
of
(b) Is, indien een wettelijke toelating wordt aangevraagd door iemand anders dan de toekomstige importeur (wat op basis van de nationale regelgeving mogelijk is), de voorafgaande kennisgeving door de aanvrager van de wettelijke toelating geldig, wanneer hij niet voornemens is het farmaceutische product zelf in te voeren of in de handel te brengen maar de voorgenomen invoer en het in de handel brengen zullen plaatsvinden op basis van de wettelijke toelating die aan de aanvrager is verleend? En
(i) Maakt het daarbij verschil of in de voorafgaande kennisgeving de persoon wordt vermeld die het farmaceutische product zal invoeren of in de handel brengen?
(ii) Maakt het daarbij verschil of de voorafgaande kennisgeving is verzonden en de wettelijke toelating is aangevraagd door een rechtspersoon in een groep van ondernemingen die een economische eenheid vormen, en de producten worden ingevoerd of in de handel gebracht door een andere rechtspersoon van die groep, op basis van een vergunning van de eerste rechtspersoon, terwijl de voorafgaande kennisgeving de rechtspersoon die het farmaceutische product zal invoeren of in de handel brengen niet vermeldt?
Geadresseerde van de kennisgeving
4. Aan wie moet de in de tweede alinea van het specifieke mechanisme bedoelde kennisgeving worden gericht? In het bijzonder:
(a) Wordt onder begunstigde van een octrooi of aanvullend beschermingscertificaat enkele diegene begrepen die naar nationaal recht het recht heeft om een rechtsvordering in te stellen om dat octrooi of aanvullend beschermingscertificaat te doen gelden?
of
(b) Volstaat het, wanneer een groep ondernemingen een economische eenheid vormt die bestaat uit een aantal rechtspersonen, om de kennisgeving te richten aan de rechtspersoon die in de lidstaat van invoer de operationele dochteronderneming en houder van de vergunning voor het in de handel brengen is, in plaats van aan de entiteit in de groep die naar nationaal recht het recht heeft om een rechtsvordering in te stellen om het octrooi of aanvullend beschermingscertificaat te doen gelden, op grond dat een dergelijke rechtspersoon kan worden gekwalificeerd als begunstigde van het octrooi of aanvullend beschermingscertificaat, of dat mag worden aangenomen dat een dergelijke kennisgeving normaliter wordt bezorgd aan de personen die beslissen namens de houder van het octrooi of aanvullende beschermingscertificaat?
(c) Indien vraag 4 (b) bevestigend wordt beantwoord, wordt een kennisgeving die voor het overige conform de voorschriften is, niet conform wanneer zij is gericht aan de „Manager, Regulatory Affairs” van een onderneming die in de groep niet de entiteit is die naar nationaal recht het recht heeft een rechtsvordering in te stellen om het octrooi of aanvullende beschermingscertificaat te doen gelden, maar de operationele dochteronderneming of houder van de vergunning voor het in de handel brengen in de lidstaat van invoer en die afdeling „Regulatory Affairs” in de praktijk regelmatig kennisgevingen van parallelimporteurs betreffende het specifieke mechanisme en andere zaken ontvangt?
Nieuw beleid VGZ dreigt aanspraken van verzekerde te beperken
Vzr. Rechtbank Gelderland 15 november 2011, ECLI:NL:RBGEL:2013:4583 (Nutricia tegen VGZ c.s.) Uitspraak ingezonden door Ilja Morée, De Brauw Blackstone Westbroek.
Uitspraak ingezonden door Ilja Morée, De Brauw Blackstone Westbroek.
VGZ c.s. is voornemens een voorkeursbeleid te hanteren ten aanzien van de verstrekking van drinkvoedingen aan hun verzekerden. Op basis van de samenstelling is drinkvoeding in vier categorieën ingedeeld, ook is per categorie één voorkeursproduct. Dit voorkeursproduct is van Fresenius Kabie en geselecteerd aan de hand van een aanbestedingsprocedure. Minimaal 75% van de te verstrekken producten moet het voorkeursproduct zijn en maximaal 25% mag verstrekt worden van niet-voorkeursproducten (waaronder van Nutricia). VGZ handelt onrechtmatig nu zij in feite de aanspraak op verstrekking van drinkvoedingen in naturapolissen beperkt. De rechtbank oordeelt dat dieetpreparaten niet op basis van samenstelling inwisselbaar zijn. De effectiviteit wordt in hoge mate bepaald door smaak, geur, substantie en textuur. Met het beleid van VGZ kan het problemen leveren indien de voorschrijver merkgebonden producten voorschrijft, nu de leverancier contractueel niet meer dan 25% mag leveren van niet-voorkeursproducten. Dit dreigt de aanspraken van de verzekerde te beperken.
Verder schrijft VGZ aanzienlijke kortingen voor bij producten die niet in de voorgenoemde vier clusters vallen. Dit doet VGZ om 'vluchtgedrag' uit de vier categorieën te voorkomen. Bij de berekening wordt op geen enkele wijze rekening gehouden met de aard en de specifieke eigenschappen van het product en de kostprijs daarvan. Hierdoor kunnen leveranciers aanmerkelijke verliezen lijden. De voorzieningenrechter acht deze manier van ontmoediging onrechtmatig.
De voorzieningenrechter verbiedt uitvoering te geven aan zorgcontracten voor 2014 en verdere gelijke contracten te sluiten.
Beoordeling
4.8 De stelling van de verste strekking van SPVD c.s. is dat de aard van dieetpreparaten en de behoeften waarin die moeten voorzien aan een preferentiebeleid, zoals dat voor geneesmiddelen mogelijk is, in de weg staan. SPVD c.s. bestrijden in dat verband dat het mogelijk is drinkvoedingen in te delen in categorieën van onderling uitwisselbare producten. Geconstateerd moet worden dat de werking van geneesmiddelen wordt bepaald door de daarin aanwezige werkzame stoffen. Daarom zijn geneesmiddelen met dezelfde werkzame stoffen onderling uitwisselbaar. Daarop is de door de wetgever geboden mogelijkheid tot het voeren van een preferentiebeleid gebaseerd, zoals blijkt uit art. 2.8 lid 3 Bz. Bij dieetpreparaten, die niet geneesmiddelen maar waren zijn, kan niet in vergelijkbare zin van werkzame stoffen worden gesproken. Dieetpreparaten zijn voedingsmiddelen. Aannemelijk is de stelling van SPVD c.s. dat de effectiviteit, in de zin van bereidheid van de daarop aangewezen patiënt tot gebruik, in hoge mate wordt bepaald door smaak, geur, substantie en textuur en daarmee door de exacte samenstelling en dat de voorkeuren daarvoor en de verdraagzaamheid daarvan hoogst individueel en subjectief bepaald zijn. Daartegenover hebben VGZ c.s. slechts gesteld dat zij de indeling in clusters hebben gemaakt aan de hand van (wetenschappelijke) literatuur over dieetvoeding en op die grond tot de slotsom van uitwisselbaarheid zijn gekomen. Met die enkele niet onderbouwde stelling hebben VGZ c.s. te weinig aangetoond dat sprake is van een uitwisselbaarheid van producten zonder dat daarmee afbreuk wordt gedaan aan de hiervoor als aannemelijk aanvaarde voorwaarden voor effectiviteit. Aannemelijk is dat daarover niet licht moet worden gedacht. Het gaat bij de drinkvoedingen om voeding van (ernstig) zieken die niet of in onvoldoende mate gewoon voedsel tot zich kunnen nemen en voor wie zonder drinkvoeding ondervoeding dreigt met alle mogelijke gevolgen van dien. Ter zitting is namens de aanwezige diëtiste uiteengezet dat het vinden van een voor de desbetreffende patiënt effectieve samenstelling van een dagelijks pakket aan dieetpreparaten eist dat combinaties van verschillende preparaten van verschillende fabrikanten gevormd (kunnen) worden. Vooralsnog moet worden geoordeeld dat een preferentiebeleid dat die mogelijkheid beperkt, zich met dit een en ander niet verdraagt. Ook de Nza heeft in het rapport van de beoordeling van de Modelovereenkomsten en reglementen van 2013 uitgesproken dat een preferentiebeleid ten aanzien van dieetpreparaten niet is toegestaan.
4.15 Hoewel niet exact kan worden vastgesteld welke bedrijfseconomische gevolgen de toegepaste kortingen voor Nutricia zullen hebben, is voldoende aannemelijk dat Nutricia door het door VGZ c.s. gehanteerde systeem van kortingen om vluchtgedrag van afleveraars af te snijden haar afzetmogelijkheden voor geconcentreerde drinkvoedingen aanzienlijk zal zien verminderen. VGZ c.s. hebben 26% van de zorgverzekeringsmarkt in Nederland in handen, wat betekent dat er een gerede kans is dat de afzet met een soortgelijk percentage zal afnemen. Mede in aanmerking genomen deze kans op aanzienlijke schade hadden VGZ c.s. zich onder al de hiervoor genoemde omstandigheden van het vaststellen van deze jegens Nutricia willekeurige kortingen op deze willekeurige wijze moeten onthouden. Het is op zichzelf begrijpelijk (en maatschappelijk aanvaardbaar) dat VGZ c.s. streven naar beteugeling van de kosten voor drinkvoedingen, ook door te trachten te voorkomen dat zij vergoedingen moet betalen voor (te) hoge winstmarges, maar de wijze waarop VGZ c.s. dat thans hebben gedaan is onzorgvuldig jegens Nutricia.
Conclusie A-G: octrooi en certificaat per beschermd product
Conclusie A-G HvJ EU 14 november 2013, zaak C-484/12 (Georgetown University) - dossier
.gif) Zie eerder: IEF 11908 en IEF 11581. Prejudiciële vragen gesteld door Rechtbank ’s-Gravenhage. Uitlegging van de artikelen 3, sub c, en 14, sub b, van ABC-geneesmiddelenverordening. Voorwaarden voor het verkrijgen van een certificaat. Basisoctrooi dat meerdere producten beschermt. Al dan geen recht op certificaat voor ieder product.
Zie eerder: IEF 11908 en IEF 11581. Prejudiciële vragen gesteld door Rechtbank ’s-Gravenhage. Uitlegging van de artikelen 3, sub c, en 14, sub b, van ABC-geneesmiddelenverordening. Voorwaarden voor het verkrijgen van een certificaat. Basisoctrooi dat meerdere producten beschermt. Al dan geen recht op certificaat voor ieder product.
Conclusie A-G:
„1) Afstand van het aanvullende beschermingscertificaat wordt beheerst door artikel 14, sub b, van verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen, en niet door nationaal recht. Aangezien afstand enkel voor de toekomst werkt, kan bovendien niet achteraf ervan worden uitgegaan dat door die afstand voor het betrokken product nooit een certificaat in de zin van artikel 3, sub c, van die verordening is afgegeven.
2) In de situatie waarin een aanvrager meerdere aanvragen voor aanvullende beschermingscertificaten heeft ingediend voor verschillende, maar door eenzelfde octrooi beschermde producten, is het aan hem te beslissen welke van die aanvragen voorrang heeft. Bij gebreke van die keuze is het aan de nationale autoriteiten om daar de eventuele gevolgen naar nationaal recht aan te verbinden.”
Gestelde vragen:
Vraag 1 Verzet Verordening 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen, meer in het bijzonder artikel 3, aanhef en onder c daarvan, zich ertegen dat, in de situatie dat een van kracht zijnd basisoctrooi meerdere producten beschermt, aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten?
Vraag 2 Indien de eerste vraag bevestigend moet worden beantwoord, hoe dient artikel 3, aanhef en onder c, van de Verordening te worden uitgelegd in de situatie dat een van kracht zijnd basisoctrooi meerdere producten beschermt en op de aanvraagdatum van een certificaat voor één van de door het basisoctrooi beschermde producten (A), weliswaar nog geen certificaten waren verkregen voor andere producten (B, C) beschermd door hetzelfde basisoctrooi, doch op die aanvragen voor de producten (B, C) certificaten zijn afgegeven voordat op de aanvrage voor een certificaat voor het eerstgenoemde product (A) is beslist?
Vraag 3 Is het voor de beantwoording van de vorige vraag van belang of de aanvrage voor één van de door het basisoctrooi beschermde producten (A) op dezelfde datum is ingediend als de aanvragen voor andere producten (B, C) beschermd door hetzelfde basisoctrooi?
Vraag 4 Indien de eerste vraag bevestigend moet worden beantwoord, kan een certificaat worden afgegeven voor een door een van kracht zijnd basisoctrooi beschermd product, indien reeds eerder voor een ander door hetzelfde basisoctrooi beschermd product een certificaat is afgegeven, maar van dit laatste certificaat door de aanvrager afstand wordt gedaan met het oogmerk een nieuw certificaat te kunnen verkrijgen op basis van hetzelfde basisoctrooi?
Vraag 5 Indien het voor beantwoording van de vorige vraag relevant is of de afstand terugwerkende kracht heeft, wordt de vraag of afstand terugwerkende kracht heeft beheerst door artikel 14, aanhef en onder b, van de Verordening of door het nationale recht? Indien de vraag of afstand terugwerkende kracht heeft wordt beheerst door artikel 14, aanhef en onder b, van de Verordening, dient die bepaling zo te worden uitgelegd dat afstand terugwerkende kracht heeft?















