Gokverslaving en hypersexualiteit als ongewenste bijwerkingen tijdig vermeld?
Rechtbank Utrecht 5 december 2012, LJN BY7842 (Permax)
 Ongewenste bijwerkingen tijdig vermeld? Benoeming deskundige. Artikelen 6:162 BW 6:185 BW 6:186 BW.
Ongewenste bijwerkingen tijdig vermeld? Benoeming deskundige. Artikelen 6:162 BW 6:185 BW 6:186 BW.
Eiser stelt dat de producent van Permax, een geneesmiddel tegen de ziekte van Parkinson, onrechtmatig ten opzichte van hem heeft gehandeld, omdat zij heeft verzuimd tijdig in de bijsluiter van Permax te vermelden dit medicijn pathologische gokverslaving en hypersexualiteit als ongewenste bijwerking kan hebben. De rechtbank is voornemens een onafhankelijke deskundige te benoemen met specialistische kennis op het gebied van de farmacologie en in het bijzonder op het gebied van de geneesmiddelenbewaking (“farmacovigilance”). Het deskundigenbericht wordt gevraagd met het doel de rechtbank in staat te stellen een gefundeerd oordeel te geven over de vraag of bedrijf onrechtmatig heeft gehandeld. Het deskundigebericht moet op zijn minst de volgende onderwerpen bevatten:
informatie over de relatie tussen dopamine agonisten en gokverslaving, hoeverre op grond van de beschikbare informatie op [bedrijf 1] de verplichting rustte zelf nader onderzoek te verrichten en op welk moment [bedrijf 1] de redelijkerwijs ter beschikking staande informatie en door eigen nader onderzoek te verkrijgen gegevens aanpassing van de door haar verstrekte informatie door middel van de bijsluiter en/of de aan de voorschrijvend medici noodzakelijk maakte.
Op andere blogs:4.2. [eiser] baseert zijn vordering op artikel 6:162 van het burgerlijk Wetboek (BW) en stelt daartoe dat [bedrijf 1] onrechtmatig ten opzichte van hem heeft gehandeld, omdat zij heeft verzuimd tijdig in de bijsluiter van Permax te vermelden dat dit medicijn pathologische gokverslaving en hypersexualiteit als ongewenste bijwerking kan hebben en omdat [bedrijf 1] heeft verzuimd tijdig onderzoek te doen naar deze ongewenste bijwerkingen. [eiser] stelt dat in de wetenschappelijke literatuur reeds in 1997 een relatie werd gelegd tussen het gebruik van dopamine agonisten en gokverslaving.
[eiser] kon echter pas medio 2005 een verband leggen tussen zijn bijzondere gedrag en de medicijnen die hij slikte. Indien hij eerder bekend zou zijn geweest met deze bijwerking had hij eerder maatregelen kunnen nemen om deze verslaving en de gevolgen daarvan te beperken.(...)
Deskundige
5.26. Gelet op hetgeen in 5.24 is overwogen heeft de rechtbank het voornemen een onafhankelijke deskundige te benoemen met specialistische kennis op het gebied van de farmacologie en in het bijzonder op het gebied van de geneesmiddelenbewaking (“farmacovigilance”). Het deskundigenbericht wordt gevraagd met het doel de rechtbank in staat te stellen een gefundeerd oordeel te geven over de vraag of [bedrijf 1] onrechtmatig heeft gehandeld ten aanzien van [eiser] door niet eerder dan in november 2006 in de bijsluiter melding te maken van de bevindingen betreffende gokverslaving. Zoals eerder is overwogen neemt de rechtbank daarbij als uitgangspunt dat bij [eiser] sprake is van een gokverslaving en dat er causaal verband is tussen deze gokverslaving en het geneesmiddel Permax. De vraagstelling aan de deskundige betreft dan ook niet dit causaal verband, maar dient er toe duidelijkheid te verkrijgen welke informatie betreffende een relatie tussen dopamine agonisten en gokverslaving [bedrijf 1] redelijkerwijs voor november 2006 bekend kon zijn, op welk moment zij over deze informatie kon beschikken en welke consequenties zij daaraan in het kader van de geneesmiddelenbewaking diende te verbinden.5.28. De aan de deskundige te stellen vragen dienen in ieder geval de volgende onderwerpen te betreffen:
- Welke informatie over de relatie tussen dopamine agonisten en gokverslaving voor november 2006 beschikbaar was en [bedrijf 1] redelijkerwijs bij haar geneesmiddelenbewaking diende te betrekken
- In hoeverre op grond van de beschikbare informatie op [bedrijf 1] de verplichting rustte zelf nader onderzoek te verrichten naar de relatie tussen Permax en gokverslaving,
- Op welk moment [bedrijf 1] de redelijkerwijs ter beschikking staande informatie en - voor zover aan de orde - door eigen nader onderzoek te verkrijgen gegevens aanpassing van de door haar verstrekte informatie door middel van de bijsluiter en/of de aan de voorschrijvend medici noodzakelijk maakte.
Nederlands Juridisch Dagblad (Gokverslaving door parkinsonpillen, niet tijdig in bijsluiter, rechter neemt causaal verband aan)
Statuten Zorgpunt Thuiszorg voldoet niet aan de Zorgbrede Governancecode

 Statuten zorgaanbieder. Geen aanbestedingsprocedure. Zorgbrede Governancecode. In navolging van het geding in eerste aanleg (BY1183) volgt uit de beleidsregel de contracteerruimte 2013 van de Nederlandse Zorgautoriteit (hierna: de NZa) dat de statuten voldoen niet aan de eisen gesteld in de Zorgbrede Governancecode (ZGC). Het hof is van oordeel dat Zorgpunt Thuiszorg onvoldoende aannemelijk heeft gemaakt dat CZ welbewust overeenkomsten voor 2013 heeft gesloten met zorgaanbieders van wie uit de statuten niet bleek dat zij de ZGC hebben ingevoerd. Op CZ rust niet de plicht alle zorgaanbieders op dat punt te controleren, zij mag volstaan met een steekproefsgewijze controle en een controle als er aanwijzingen zijn dat er iets niet in orde is.
Statuten zorgaanbieder. Geen aanbestedingsprocedure. Zorgbrede Governancecode. In navolging van het geding in eerste aanleg (BY1183) volgt uit de beleidsregel de contracteerruimte 2013 van de Nederlandse Zorgautoriteit (hierna: de NZa) dat de statuten voldoen niet aan de eisen gesteld in de Zorgbrede Governancecode (ZGC). Het hof is van oordeel dat Zorgpunt Thuiszorg onvoldoende aannemelijk heeft gemaakt dat CZ welbewust overeenkomsten voor 2013 heeft gesloten met zorgaanbieders van wie uit de statuten niet bleek dat zij de ZGC hebben ingevoerd. Op CZ rust niet de plicht alle zorgaanbieders op dat punt te controleren, zij mag volstaan met een steekproefsgewijze controle en een controle als er aanwijzingen zijn dat er iets niet in orde is.
Het algemene belang van een efficiënte en voortvarende procedure van verdeling van de gelden prevaleert boven het belang van de inschrijver die niet voldoet aan de eisen van het inkoopdocument. Het feit dat Zorgpunt Thuiszorg zeer goede zorg levert, brengt niet mee dat andere zorgaanbieders dat niet ook kunnen. Terecht heeft de voorzieningenrechter overwogen dat Zorgpunt Thuiszorg bezwaar had kunnen maken tegen de eisen van het inkoopdocument. De stelling van Zorgpunt Thuiszorg dat er voor haar geen reden was om daartegen bezwaar te maken omdat zij de interpretatie van CZ van artikel 4.2 lid 9 ZGC niet kon voorzien, gaat niet op. De slotsom is dat de grieven van Zorgpunt Thuiszorg niet tot vernietiging van het vonnis kunnen leiden.
Het vonnis wordt bekrachtigd.
4.10.3. Het hof is van oordeel dat Zorgpunt Thuiszorg onvoldoende aannemelijk heeft gemaakt dat CZ welbewust overeenkomsten voor 2013 heeft gesloten met zorgaanbieders van wie uit de statuten niet bleek dat zij de ZGC hebben ingevoerd. Op CZ rust niet de plicht alle zorgaanbieders op dat punt te controleren, zij mag volstaan met een steekproefsgewijze controle en een controle als er aanwijzingen zijn dat er iets niet in orde is. De verklaring van CZ dat Ambulante Thuiszorg in 2013 in onderaanneming bij een wel gecontracteerde zorgaanbieder werkzaam zal zijn komt het hof aannemelijk voor.
4.11.2. Het hof onderschrijft het oordeel van de voorzieningenrechter zoals opgenomen in rechtsoverweging 3.9. Het algemene belang van een efficiënte en voortvarende procedure van verdeling van de gelden prevaleert boven het belang van de inschrijver die niet voldoet aan de eisen van het inkoopdocument. Het feit dat Zorgpunt Thuiszorg zeer goede zorg levert, brengt niet mee dat andere zorgaanbieders dat niet ook kunnen. Terecht heeft de voorzieningenrechter overwogen dat Zorgpunt Thuiszorg bezwaar had kunnen maken tegen de eisen van het Inkoopdocument; zie ook HvJEG 24 februari 2004, zaak C-230/02 (Grossmann). De stelling van Zorgpunt Thuiszorg dat er voor haar geen reden was om daartegen bezwaar te maken omdat zij de interpretatie van CZ van artikel 4.2 lid 9 AGC niet kon voorzien gaat niet op, zoals blijkt uit 4.6.3.Uit LJN BY1183:
3.9. Zorgpunt Thuiszorg beroept zich op de afweging van de belangen: een blijvende afwijzing van het zorgcontract voor het jaar 2013 zou het einde betekenen voor Zorgpunt Thuiszorg en in geen verhouding staan tot het geringe belang van CZ bij handhaving van de weigering. Ook dit argument overtuigt niet: van algemene bekendheid is dat het bij de verdeling van de AWBZ-gelden zeer grote bedragen betreft die over zeer veel zorgaanbieders in korte tijd moeten worden toegekend met inachtneming van de beginselen van transparantie en gelijkheid. Het Inkoopdocument 2013 geeft daar vorm aan. Zorgaanbieders kunnen bezwaar maken tegen het document en aanpassing vragen. Het algemene belang van een efficiënte en voortvarende procedure van verdeling van de gelden prevaleert boven het belang van de inschrijver die niet voldoet aan de eisen van het Inkoopdocument.Gesteld noch gebleken is dat het belang van voldoende AWBZ-zorg bij deze strikte systematiek in gevaar komt.
Feitencomplex is nagenoeg gelijk, het juridisch geschilpunt anders
Rechtbank Arnhem 5 december 2012, LJN BY7777 (eiser tegen verweerder)
 Incidentele vordering tot verwijzing. Eiser verzoekt verwijzing wegens connexiteit [red. met LS&R 357] art. 220 lid 1 Rv. Incidentele vordering afgewezen. Het feitencomplex mag dan nagenoeg gelijk zijn, het juridisch geschilpunt is wel degelijk anders. Waar de vordering van verweerder is gebaseerd op de overeenkomst van 1 oktober 1999, is de vordering van eiser gebaseerd op de overeenkomst van 30 augustus 2011. Dat beide overeenkomsten verband houden met de overeenkomst van 13 maart 1997 maakt nog niet dat er sprake is van een zodanige samenhang dat verwijzing in de rede ligt.
Incidentele vordering tot verwijzing. Eiser verzoekt verwijzing wegens connexiteit [red. met LS&R 357] art. 220 lid 1 Rv. Incidentele vordering afgewezen. Het feitencomplex mag dan nagenoeg gelijk zijn, het juridisch geschilpunt is wel degelijk anders. Waar de vordering van verweerder is gebaseerd op de overeenkomst van 1 oktober 1999, is de vordering van eiser gebaseerd op de overeenkomst van 30 augustus 2011. Dat beide overeenkomsten verband houden met de overeenkomst van 13 maart 1997 maakt nog niet dat er sprake is van een zodanige samenhang dat verwijzing in de rede ligt.
2.5. In de onderhavige zaak is de vordering van [eiser] gebaseerd op een vaststellingsovereenkomst tussen [verweerder] en Medtronic gedateerd 30 augustus 2011. [eiser] stelt dat uit deze laatste overeenkomst blijkt dat Medtronic een bedrag van US$ 70.000,-- aan [verweerder] diende te betalen en dat de grondslag van deze betaling naar haar aard gelijk is aan de grondslag van de betaling die door [eiser] van Medtronic is ontvangen. [eiser] bepleit dat beide vorderingen gebaseerd zijn op dezelfde overeenkomst, namelijk de overeenkomst van 13 maart 1997 en dat in beide zaken hetzelfde feitencomplex speelt. Om die reden verzoekt hij om verwijzing wegens connexiteit.
2.6. Artikel 220 lid 1 Rv. bepaalt, voor zover hier van belang, dat ingeval de zaak verknocht is aan een zaak die reeds bij een andere gewone rechter van gelijke rang aanhangig is, de verwijzing naar die andere rechter kan worden gevorderd. Blijkens de parlementaire geschiedenis bij dit artikel is de ratio daarvan de bevordering van de doelmatigheid van procedures en het voorkomen van tegenstrijdige beslissingen. Het komt er op aan of de feitelijke en juridische geschilpunten in de ene zaak gelijk zijn aan die in de andere, of daarmee zodanig samenhang vertonen dat consistentie van de uitspraken wenselijk is.
2.7. De rechtbank is van oordeel dat de incidentele vordering moet worden afgewezen, omdat de aangevoerde gronden die vordering niet kunnen dragen. Immers, het feitencomplex mag dan nagenoeg gelijk zijn, het juridisch geschilpunt is wel degelijk anders. Waar de vordering van [verweerder] is gebaseerd op de overeenkomst van 1 oktober 1999, is de vordering van [eiser] gebaseerd op de overeenkomst van 30 augustus 2011. Dat beide overeenkomsten verband houden met de overeenkomst van 13 maart 1997 maakt nog niet dat er sprake is van een zodanige samenhang dat verwijzing in de rede ligt.
Reguliere presentatie van een mobiel verkooppunt van sigaretten
CBB 22 november 2012, LJN BY7506 (Philip Morris B.V. tegen Minister van VWS)
 Er is geen sprake van een reguliere presentatie als bedoeld in artikel 5, derde lid, aanhef en onder b, van de Tabakswet, wanneer een mobiel verkooppunt op evenementen wordt ingezet en dat dit verkoop punt "een futuristisch vormgegeven metallic grijze caravan met een groot bord met het woord "Cigarettes" betreft. Het verbod op tabaksreclame uit artikel 5 lid 1 van de Tabakswet is onverminderd van toepassing. Er is geen aanleiding om terug te komen op eerdere uitspraken van het College. Geen strijd met rechtszekerheidsbeginsel of vertrouwensbeginsel. Vanwege de overschrijding van de redelijke termijn met iets meer dan 8 maanden leidt dit (in lijn met het arrest van de Hoge Raad van 19 december 2008, LJN BD0191), tot een matiging van de boetes met 30%, zij het met een maximum van € 7.500,- per boete.
Er is geen sprake van een reguliere presentatie als bedoeld in artikel 5, derde lid, aanhef en onder b, van de Tabakswet, wanneer een mobiel verkooppunt op evenementen wordt ingezet en dat dit verkoop punt "een futuristisch vormgegeven metallic grijze caravan met een groot bord met het woord "Cigarettes" betreft. Het verbod op tabaksreclame uit artikel 5 lid 1 van de Tabakswet is onverminderd van toepassing. Er is geen aanleiding om terug te komen op eerdere uitspraken van het College. Geen strijd met rechtszekerheidsbeginsel of vertrouwensbeginsel. Vanwege de overschrijding van de redelijke termijn met iets meer dan 8 maanden leidt dit (in lijn met het arrest van de Hoge Raad van 19 december 2008, LJN BD0191), tot een matiging van de boetes met 30%, zij het met een maximum van € 7.500,- per boete.
Onder het reclameverbod bij evenementen vallen volgens de rechtbank niet alleen, zoals appellante heeft gesteld, mobiele verkooppunten die “raar”of “stuntachtig” zijn. Weliswaar is deze caravan grijs van kleur en niet, zoals vroeger in de kleur rood van het eigen product Marlboro, maar de gehele uitstraling van het verkooppunt is van dien aard, dat de aandacht van het publiek gevestigd wordt op dit verkooppunt van sigaretten.
Uit de wetsgeschiedenis blijkt dat de wetgever heeft beoogd rare stuntachtige verkoopmethoden tegen te gaan. De door het College gehanteerde “supermarktnorm” strekt volgens appellante verder dan dat. Daarmee wordt echter niet het verbod op tabaksreclame beperkt in de zin die appellante bedoelt. De gehele uitstraling van het verkooppunt door het gebruik van een futuristisch vormgegeven metallic grijze caravan met daarboven op hoog niveau een groot bord met het woord “Cigarettes” boven een afbeelding van een brandende sigaret is van dien aard dat de aandacht van het publiek is gevestigd op dit verkooppunt van sigaretten.
5.1. (...) Het College ziet geen aanleiding om thans terug te komen van het in voornoemde uitspraken van 20 december 2007 en 16 september 2008 gegeven oordeel over de strekking en reikwijdte van de in artikel 5, derde lid, aanhef en onder b, van de Tabakswet neergelegde uitzondering op het reclameverbod. Het standpunt van appellante dat dit oordeel zich niet verdraagt de wetgeschiedenis wordt niet onderschreven. Appellante heeft betoogd dat uit de wetsgeschiedenis blijkt dat alleen rare stuntachtige methoden verboden zijn. Het College overweegt dat de woorden “rare stuntachtige methoden” in de wetsgeschiedenis (Kamerstukken II, 2000-2001, 26 472, nr. 7, p. 22) niet in dat verband worden gebezigd. De wetgever heeft deze terminologie gebruikt om aan te geven dat met het toestaan van een reguliere presentatie rare stuntachtige methoden kunnen worden voorkomen. Daarmee wordt echter niet het verbod op tabaksreclame beperkt in de zin die appellante bedoelt. Appellante geeft met haar stelling naar het oordeel van het College op dit punt blijk van een te beperkte en onjuiste uitleg van het verbod op tabaksreclame en de hierop toegestane uitzondering.
5.3 Ten aanzien van de bepaalbaarheid van de in artikel 5, derde lid, aanhef en onder b, van de Tabakswet in samenhang bezien met de in het eerste lid van dat artikel neergelegde verbodsnorm heeft het College in voornoemde uitspraken geoordeeld dat de in deze bepaling geformuleerde norm voldoende concreet duidelijk maakt welke gedragingen met betrekking tot de presentatie van tabaksproducten zijn toegestaan en daarmee tevens welke gedragingen op grond van het eerste lid van dat artikel verboden en beboetbaar zijn. Voorts heeft het College in die uitspraken geoordeeld dat deze norm degene tot wie zij is gericht voldoende in staat stelt zijn gedrag daarop af te stemmen. Het College ziet geen aanleiding op dit punt thans anders te oordelen. Het standpunt van appellante dat de norm in strijd is met het lex certa beginsel en de minister door hantering van deze norm in strijd met de rechtszekerheid heeft gehandeld, kan dan ook niet worden gevolgd.
5.3 Het College ziet zich vervolgens voor de vraag gesteld of het tijdens de evenementen van 11 juni 2005, 23 juli 2005 en 28 januari 2006 gebruikte mobiele verkooppunt als een reguliere presentatie als bedoeld in artikel 5, derde lid, aanhef en onder b, van de Tabakswet kan worden aangemerkt.
Het College is van oordeel dat geen sprake is van een sobere uitstalling van verpakkingen van tabaksproducten die niet verder strekt dan nodig is om aan te tonen welk tabaksproduct voor welke prijs wordt verkocht. Daartoe wordt overwogen dat de gehele uitstraling van het verkooppunt door het gebruik van een futuristisch vormgegeven metallic grijze caravan met daarboven op hoog niveau een groot bord met het woord “Cigarettes” boven een afbeelding van een brandende sigaret van dien aard is dat de aandacht van het publiek is gevestigd op dit verkooppunt van sigaretten. Voorts worden de tabaksproducten door de aandachttrekkende elementen aan de binnen- en buitenzijde van de caravan zodanig gepresenteerd dat deze presentatie als geheel op een met het reclameverbod onverenigbare wijze de aandacht van het aanwezige publiek op te koop aangeboden tabaksproducten vestigt. Daarbij moet onder meer worden gedacht aan de indirect verlichte wand met aan beide zijden de aanduiding “cigarettes”. Voorts speelt mee dat de tabaksproducten van onder de toonbank werden verkocht en daaruit volgt dat de schappen en de doorzichtige lade in de balie als presentatie dienden. Gelet op de door de minister overgelegde foto’s, volgt het College, evenals de rechtbank, appellante niet in haar standpunt dat de producten uitsluitend zichtbaar waren in de toonbank en in twee kleine schappen en daarmee slechts voor personen in het verkooppunt.
Het standpunt van appellante dat de rechtbank in strijd met het verbod op reformatio in peius heeft gehandeld, snijdt geen hout. Genoemd verbod heeft betrekking op de uitkomst van een bezwaar- of beroepsprocedure en niet op afzonderlijke overwegingen die tot die uitkomst leiden.
5.4 Het College komt op grond van het vorenstaande tot de conclusie dat met betrekking tot het onderhavige verkooppunt geen sprake is van een reguliere presentatie en dat het in artikel 5, eerste lid, van de Tabakswet neergelegde verbod op elke vorm van tabaksreclame daarop onverminderd van toepassing is. Het College is van oordeel dat de wijze van presenteren van de te koop aangeboden tabaksproducten ten doel heeft de verkoop van die producten te bevorderen, dan wel daaraan bekendheid te geven of het aan te prijzen. Appellante heeft dan ook in strijd met het hierbedoelde verbod op tabaksreclame gehandeld. De ontkenning van appellante dat sprake is van bevordering van de verkoop van tabaksproducten, brengt het College niet tot een ander oordeel.
Moties geneesmiddelenbeleid
.gif) Een zestal moties inzake geneesmiddelenbeleid.
Een zestal moties inzake geneesmiddelenbeleid.
Geneesmiddelenbeleid Motie Dijkstra (uniforme barcodering geneesmiddelen en medische hulpmiddelen), Kamerstukken 29 477, nr. 218.
constaterende dat er op dit moment in Nederland nog geen uniform systeem van barcodering voor geneesmiddelen en medische hulpmiddelen wordt gehanteerd;
overwegende dat uniforme barcodering voor geneesmiddelen en medische hulpmiddelen per jaar grote besparingen oplevert in verminderde administratieve lasten;
overwegende dat wachten op regelgeving van de Europese Commissie betekent dat implementatie langer zal duren, terwijl zorgpartijen in Nederland nu vragen om wetgeving;
overwegende dat uniforme barcodering een aanzienlijke verlaging van de kans op foutieve toediening van medicijnen en foutief gebruik van medische hulpmiddelen teweegbrengt;
overwegende dat uniforme barcodering de mogelijkheden tot het vervalsen van geneesmiddelen en medische hulpmiddelen verkleint;
verzoekt de regering, over te gaan tot het invoeren van wetgeving voor uniforme barcodering voor geneesmiddelen en medische hulpmiddelen,
Geneesmiddelenbeleid motie Dijkstra c.s. (openbaarmaken prijslijsten), Kamerstukken II 2012/13, 29 477, nr. 217.
overwegende dat de Kamer ongelukkig is met intransparante prijsafspraken voor geneesmiddelen in preferentiebeleid en pakjesmodellen;
overwegende dat alle prijzen transparant moeten zijn;
overwegende dat het stapelen van systemen, preferentiebeleid, prijsvolume afspraken, pay for performance etc. het nog moeilijker maakt te zien wat de waarde van geneesmiddelen moet zijn;
overwegende dat patiënten hierdoor niet kunnen nakijken in landelijke prijslijsten wat geneesmiddelen kosten en of het in rekening gebrachte eigen risico de werkelijke kosten betreft;
constaterende dat er verschil van mening is over de gevolgen van het transparant maken van het preferentiebeleid;
verzoekt de regering, een onderzoek in te stellen naar de voor- en nadelen van het openbaar maken van de prijslijsten voor alle mogelijke systemen en een wijziging in het Besluit Zorgverzekering voor te bereiden.
Geneesmiddelenbeleid motie Voortman (Financiële arrangementen), Kamerstukken II 2012/13, 29 477, nr. 216.
overwegende dat er gestreefd moet worden naar zo veel mogelijk transparantie ten aanzien van de prijs van geneesmiddelen;
overwegende dat zorgverzekeraars als belanghebbende partij in staat moeten zijn farmaceutische zorg zo doelmatig mogelijk in te kopen;
constaterende dat de minister van Volksgezondheid middels een pilot vertrouwelijke financiële arrangementen heeft afgesloten met de fabrikanten van de NOAC's;
overwegende dat zorgverzekeraars in een onmogelijke spagaat komen doordat zij wel risico dragen, maar geen inzicht hebben in de financiële arrangementen;
verzoekt de regering, zorgverzekeraars vertrouwelijk te informeren over de betreffende financiële arrangementen en mocht dit op basis van afspraken met fabrikanten niet mogelijk zijn, dan wordt de regering verzocht om zorgverzekeraars voor de looptijd van de financiële arrangementen geen financieel risico over de kosten van NOAC's te laten lopen,
Geneesmiddelenbeleid motie Van Gerven (College Zorgverzekeringen), Kamerstukken II 2012/13, 29 477, nr. 215.
overwegende dat het wenselijk is een deugdelijke toets te laten uitvoeren op nieuwe geneesmiddelen door het College voor Zorgverzekeringen (CVZ) alvorens het een advies uitbrengt over het vergoeden van medicijnen;
spreekt uit dat de capaciteit van het CVZ uitgebreid moet worden, zodat een deugdelijke toets op veiligheid, effectiviteit en doelmatigheid goed en tijdig kan worden uitgevoerd,
Geneesmiddelenbeleid motie Van Gerven (Acute farmaceutische zorg), Kamerstukken II 2012/13, 29 477, nr. 214.
overwegende dat de dienstapotheek (voor avond-, nacht- en weekenddiensten) een belangrijke voorziening is;
constaterende dat het voortbestaan van dienstapotheken in het geding is, zoals in Haarlem, Zoetermeer en Roermond;
verzoekt de regering, te bevorderen dat voorzieningen voor acute farmaceutische zorg waar mogelijk in nabijheid van huisartsenposten worden gerealiseerd;
en spreekt uit dat er een adequate, transparante, financiële regeling moet komen voor dienstapotheken,
Geneesmiddelenbeleid motie Van Gerven (niet vergoeden NOAC), Kamerstukken II 2012/13, 29 477, nr. 213.
overwegende dat de veiligheid van de patiënt voorop moet staan bij het voorschijven en gebruiken van geneesmiddelen;
constaterende dat na de introductie van het nieuwe antistollingsmiddel dabigatran (NOAC) in de Verenigde Staten in 2011 542 fatale bijwerkingen zijn gemeld door het FDA, tegenover 72 dodelijke bijwerkingen bij het traditionele cumarinederivaat warfarine;
constaterende dat in Nederland tot nu toe acht dodelijke bijwerkingen van dabigatran zijn gemeld bij het Lareb, terwijl het middel nog niet werd vergoed;
verzoekt de regering om, de NOAC's vooralsnog niet te vergoeden, maar verder onderzoek te doen naar de veiligheid van NOAC's onder Nederlandse verhoudingen,
Ongeschikte hulpzaak ziekenhuis
Rechtbank Arnhem 28 november 2012, LJN BY6606 (eiser tegen Stichting Katholieke Universiteit (UMC St. Radboud)
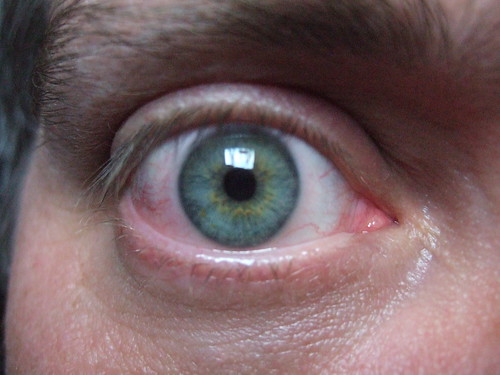 Vervolg op LJN BL6937: Vordering tot vergoeding door het ziekenhuis van materiële en immateriële schade, veroorzaakt door in 1992 in het rechteroog van eiser aangebrachte "plombe". Heeft het ziekenhuis bij de uitvoering van de verbintenis gebruikt van een daartoe ongeschikte zaak (art. 6:77 BW)? Mocht, gelet op de stand van de medische wetenschap in 1992, een redelijk handelend en vakbekwaam oogarts in 1992 een plombe van het bewuste type gebruiken, zonder voorafgaande voorlichting aan eiser? Rechtbank heeft behoefte aan voorlichting door deskundige. LJN BN3376: Benoeming deskundige en formulering aan hem te stellen vragen.
Vervolg op LJN BL6937: Vordering tot vergoeding door het ziekenhuis van materiële en immateriële schade, veroorzaakt door in 1992 in het rechteroog van eiser aangebrachte "plombe". Heeft het ziekenhuis bij de uitvoering van de verbintenis gebruikt van een daartoe ongeschikte zaak (art. 6:77 BW)? Mocht, gelet op de stand van de medische wetenschap in 1992, een redelijk handelend en vakbekwaam oogarts in 1992 een plombe van het bewuste type gebruiken, zonder voorafgaande voorlichting aan eiser? Rechtbank heeft behoefte aan voorlichting door deskundige. LJN BN3376: Benoeming deskundige en formulering aan hem te stellen vragen.
Eindvonnis; vordering tot vergoeding van materiële en immateriële schadevergoeding afgewezen; de tekortkoming (ongeschikte hulpzaak, art. 6:77 BW) kan niet aan het ziekenhuis worden toegerekend. Over soortgelijke materie is ook bij de Nationale Ombudsman geklaagd: rapportnr. 2012-015.
Aansprakelijkheid ziekenhuis
2.5. Uit de conclusie na deskundigenbericht van [eiser] leidt de rechtbank af dat de gronden waarop [eiser] de aansprakelijkheid van het ziekenhuis baseert, uiteenvallen in het gebruik van een ongeschikte hulpzaak enerzijds (artikel 6:77 BW) en het niet handelen als een redelijk handelend en vakbekwaam oogarts in verband met het onjuiste behandelbeleid en schending van de informatie- en dossierplicht. Die gronden worden hierna beoordeeld. Op beide gronden is zowel oud als nieuw recht van toepassing. Partijen zijn het er echter over eens dat de thans geldende wettelijke bepalingen in overeenstemming zijn met het (ongeschreven) oude recht. Omwille van de eenvoud zal daarom van de huidige wettelijke bepalingen worden uitgegaan.
2.13. [eiser] heeft nog aangevoerd dat hij geen toestemming heeft gegeven zoals bedoeld in artikel 7:450 BW voor toepassing van de Miragelplombe. Daarover oordeelt de rechtbank dat [eiser] zal hebben ingestemd met de behandeling van zijn netvliesloslating. Bij niet opereren zou hij aan dat oog immers blind zijn geworden. Die toestemming volstaat. Artikel 7:450 BW brengt niet mee dat onder alle omstandigheden voor alle afzonderlijke aspecten van een behandeling, zoals de keuze voor het materiaal en hulpzaken, toestemming moet worden verkregen.
2.14. [eiser] betoogt dat toen de fabrikant in 1996 het product van de markt had gehaald en toen in 1997 de publicatie van Hwang verscheen over de complicaties bij de Miragelplombe, het ziekenhuis [eiser] daarover had moeten informeren. In dat kader heeft hij ook gewezen op zijn belang om de producent voor het verstrijken van de vervaltermijn van artikel 6:191 BW (10 jaar na het op de markt komen van het product) aansprakelijk te kunnen stellen.
Artikel 6:77 BW
Ongeschiktheid
2.25. Partijen twisten erover of sprake is van een ongeschikte zaak als bedoeld in artikel 6:77 BW. Volgens [eiser] is dat het geval nu gebleken is en in 1992 ook al bekend had moeten en kunnen zijn dat de Miragelplombe na verloop van tijd van chemische samenstelling verandert, zwelt en fragmenteert met alle gevolgen van dien. Door die plombe te gebruiken is sprake van toerekenbaar tekortschieten door het ziekenhuis in de nakoming van de geneeskundige behandelingsovereenkomst. Het ziekenhuis bestrijdt dit. De plombe was op zich geschikt voor het doel waarvoor die is geplaatst, namelijk voor het sluiten van een netvliesscheur. Dat bij 10% van de patiënten complicaties optreden en bij een deel van die groep de Miragelplombe verwijderd moet worden, maakt het nog niet tot een ongeschikte zaak. Daarbij komt dat het ziekenhuis met de complicaties niet bekend was en niet bekend hoefde te zijn, zo stelt het ziekenhuis onder verwijzing naar het rapport van de deskundige. [eiser] bestrijdt dit nadrukkelijk.
2.26. Niet in geschil is dat de Miragelplombe als (hulp)zaak in de zin van artikel 6:77 BW moet worden aangemerkt. Een zaak is ongeschikt wanneer deze gebrekkig is of om andere redenen ongeschikt is voor het beoogde doel. Hoewel de Miragelplombe voor 90% van de patiënten bij wie de plombe is geplaatst zonder complicaties bruikbaar is gebleken bij de behandeling van een netvliesloslating, geldt dat bij 10% van de patiënten complicaties optreden en dat bij een deel van die 10% zich voordoet wat zich bij [eiser] heeft voorgedaan: de plombe verandert van chemische samenstelling, zwelt en fragmenteert.
Naar het oordeel van de rechtbank brengen die eigenschappen van de Miragelplombe mee dat deze ongeschikt is voor het beoogde doel. Daarmee staat vast dat het ziekenhuis tekort is geschoten in de nakoming van de met [eiser] gesloten behandelingsovereenkomst. Dat het ziekenhuis, zoals zij stelt, gelet op de stand van de wetenschap op het moment dat de plombe bij [eiser] werd geïmplanteerd, nog niet bekend was met deze eigenschap van de plombe, is een aspect dat hierna bij de toerekening zal worden besproken.
2.30. De rechtbank oordeelt dat de tekortkoming niet aan het ziekenhuis kan worden toegerekend. Voor dat oordeel is het volgende bepalend. In de processtukken, waaronder het deskundigenbericht, zijn geen aanknopingspunten te vinden op grond waarvan de producent van de Miragelplombe voor de schade door het gebrek in dat product aansprakelijk gehouden zou kunnen worden. Immers, uit het deskundigenbericht volgt dat er in 1992 naar de toenmalige stand van de wetenschap nog geen grond was om aan te nemen dat de Miragelplombe gebrekkig was en dat pas na 1992 voor het eerst de eigenschappen van de Miragelplombe zoals die zich ook bij [eiser] hebben geopenbaard, bekend werden. Aansprakelijkheid van de producent zou dan ook afstuiten op artikel 6:185 lid 1 aanhef en onder e BW. Tegen de achtergrond van de hiervoor geciteerde wetsgeschiedenis valt dan niet in te zien dat het ziekenhuis, dat zoals hiervoor is geoordeeld, in 1992 met het gebrek niet bekend was of kon zijn en overigens zorgvuldig heeft gehandeld, in zo’n geval wel, te weten op de voet van artikel 6:77 BW voor het gebruik van dat gebrekkige product aansprakelijk kan worden gehouden. Daarnaast brengen de verkeersopvattingen mee dat nu het ziekenhuis in 1992 niet wist of kon weten van het gebrek terwijl het in die tijd state of the art was om deze plombe te verkiezen boven de twee andere voorhanden plombes, de tekortkoming niet aan het ziekenhuis kan worden toegerekend. Een ander oordeel zou ertoe kunnen leiden dat ziekenhuizen - hoewel een genees- of medisch hulpmiddel door de betreffende instanties, in dit geval de Federal Drug Administration, is goedgekeurd en op de markt is toegelaten - vanwege mogelijke onbekende negatieve eigenschappen en daaruit voortvloeiende aansprakelijkheid, terughoudend zullen zijn in de toepassing van nieuwe genees- en hulpmiddelen. Dit staat de ontwikkeling van medische behandelmethoden in de weg. De argumenten die [eiser] heeft aangevoerd – waarvan een aantal het ziekenhuis niet valt aan te rekenen of niet in causaal verband staan met de schade zoals eerder is geoordeeld – wegen onvoldoende zwaar om tot een ander oordeel over de toerekening te leiden. Hierop stuit de vordering van [eiser] op grond van artikel 6:74 juncto 6:77 BW af.
Kleine blauwe pil is verwijzing naar Viagra
Vz. RCC 4 december 2012, dossiernr. 2012/00981 (The Natural Blue Pill)
 Indruk wekken dat het om het UR-geneesmiddel (en ingeschreven merk) Viagra gaat. Misleidende reclame. De uiting suggereert dat de blauwe pil dezelfde uitwerking heeft als Viagra, terwijl dat voor de prijs die ervoor wordt gevraagd onmogelijk is. De samenstelling van de pil wordt niet gegeven, maar de blauwe kleur verwijst zonder meer naar Viagra.
Indruk wekken dat het om het UR-geneesmiddel (en ingeschreven merk) Viagra gaat. Misleidende reclame. De uiting suggereert dat de blauwe pil dezelfde uitwerking heeft als Viagra, terwijl dat voor de prijs die ervoor wordt gevraagd onmogelijk is. De samenstelling van de pil wordt niet gegeven, maar de blauwe kleur verwijst zonder meer naar Viagra.
Door uitdrukkingen als “Dit is die kleine blauwe pil waar iedereen over praat!”, “ …uw uitgelezen kans om die kleine blauwe pil in de privacy van uw huist te testen…” en “Normaal betaalt u tot wel 50 euro voor slechts 4 pillen van 100 mg! Voor een beperkte tijd kunt u ze nu bestellen voor minder dan 12 euro voor 10 pillen!”, wordt naar het oordeel van de voorzitter de indruk gewekt dat het gaat om het uitsluitend op voorschrift verkrijgbare geregistreerde geneesmiddel Viagra.
Naar het oordeel van de voorzitter wordt door bovengenoemde uitdrukkingen een product, dat lijkt op een door een bepaalde fabrikant vervaardigd product, op een zodanige wijze gepromoot dat bij de consument doelbewust de verkeerde indruk wordt gewekt dat het product inderdaad door die fabrikant is vervaardigd, terwijl zulks niet het geval is. Naar het oordeel van de voorzitter is de reclame derhalve misleidend in de zin van artikel 8.5 NRC in verbinding met punt 16 van de bij artikel 8.5 behorende bijlage 1. Dit impliceert dat de reclame-uiting ook oneerlijk is in de zin van artikel 7 NRC.
Overmatig declareren in strijd met 35 Wmg
Rechtbank Amsterdam 21 november 2012, LJN BY7233 (Stad Holland / DSW tegen Beperfect Clinics B.V.)
 Juridische kwalificatie van handelswijze van overmatig declareren. Strijd met artikel 35 Wmg. Vonnis na afzien van dupliek. Kliniek biedt behandeling aan met een zgn. onzichtbare beugel en brengt daarvoor aan patiënten bedragen in rekening in strijd met de door de Nederlandse Zorgautoriteit vastgestelde tariefbeschikkingen (aanwijzing door NZa). Verzekeraars vorderen (na cessie) van de kliniek betaling van de ten onrechte in rekening gebrachte bedragen, die door verzekeraars aan hun verzekerden zijn vergoed. Zie uitgebreid: dentalplatform.nl
Juridische kwalificatie van handelswijze van overmatig declareren. Strijd met artikel 35 Wmg. Vonnis na afzien van dupliek. Kliniek biedt behandeling aan met een zgn. onzichtbare beugel en brengt daarvoor aan patiënten bedragen in rekening in strijd met de door de Nederlandse Zorgautoriteit vastgestelde tariefbeschikkingen (aanwijzing door NZa). Verzekeraars vorderen (na cessie) van de kliniek betaling van de ten onrechte in rekening gebrachte bedragen, die door verzekeraars aan hun verzekerden zijn vergoed. Zie uitgebreid: dentalplatform.nl
2.5. Verzekeraars hebben zich na onderzoek van de ingediende declaraties op het standpunt gesteld dat door Beperfect ten onrechte bedragen in rekening zijn gebracht.
Bij brief van 12 april 2011 hebben zij aan Beperfect bericht, voor zover relevant:
“De gehanteerde tarieven overschrijden de in de orthodontie gebruikelijke tarieven fors. Voorts, en daar hebben wij u al eerder op gewezen, zijn de facturen onvoldoende gespecificeerd, waarmee niet wordt voldaan aan de wettelijke eisen. Ook hebben wij bij verschillende nota’s geconstateerd dat behandelcodes ten onrechte in rekening gebracht zijn.”
2.8. Op 25 november 2011 heeft de NZa Beperfect een aanwijzing ex artikel 76 Wmg opgelegd om bij haar declaraties voor behandelingen met Invisalign de geldende regels te volgen.
4.5. Thans dient de vraag te worden beantwoord hoe de handelwijze van Beperfect juridisch dient te worden gekwalificeerd c.q. of er een rechtsgrond is voor de vordering van verzekeraars en zo ja, welke. Nu de behandelovereenkomsten van Beperfect met de door haar behandelde verzekerden niet zijn overgelegd en onvoldoende is gesteld of gebleken wat die behandelovereenkomsten inhouden, kan de rechtbank niet beoordelen of Beperfect is tekortgeschoten in de nakoming van haar verplichtingen uit de behandelovereenkomsten en of deze grond dus de vordering kan dragen.
Wel constateert de rechtbank met verzekeraars dat de handelwijze van Beperfect in strijd is met artikel 35 Wmg omdat in die bepaling een zorgaanbieder wordt verboden - kort gezegd - een tarief in rekening te brengen dat niet strookt met een tariefbeschikking. De onrechtmatigheid van de handelwijze van Beperfect is daarmee gegeven. Dat andere zorgaanbieders mogelijk nog hogere tarieven hanteren dan Beperfect, ontneemt niet het onrechtmatig karakter aan het handelen van Beperfect. De onrechtmatige handelwijze kan aan Beperfect worden toegerekend omdat Beperfect - zoals verzekeraars terecht stellen - als zorgaanbieder wist of behoorde te weten dat er conform de tariefbeschikkingen moet worden gedeclareerd. Het onjuiste declareren komt dus krachtens verkeersopvattingen voor rekening van Beperfect. Het verweer van Beperfect dat onduidelijk is welke codes moeten worden toegepast en dat de informatie van de NZa daarover ondoorzichtig is, houdt geen stand, gelet op de gemotiveerde betwisting daarvan door verzekeraars bij conclusie van repliek (met verwijzing naar de toelichting in de tariefbeschikkingen en tarievenlijsten) en het feit dat Beperfect haar verweer vervolgens niet bij conclusie van dupliek nader heeft onderbouwd. Voorts is er sprake van schade. In de stellingen van verzekeraars ligt besloten dat Beperfect, door (potentiële) patiënten mee te delen dat zij in haar declaraties de voor verzekeringsmaatschappijen benodigde codes uit de tariefbeschikkingen hanteert, bij de verzekerden de verwachting heeft gewekt dat patiënten die verzekerd zijn voor orthodontische zorg, de behandeling van hun verzekeraar vergoed krijgen. Tevens ligt in de stellingen van verzekeraars besloten dat verzekerden in die verwachting de declaraties van Beperfect bij hun verzekeraar hebben ingediend. Verzekerden lijden financieel nadeel doordat verzekeraars echter niet tot volledige vergoeding van het door verzekerden aan Beperfect betaalde bedrag wilden overgaan (omdat Beperfect bedragen ten onrechte in rekening heeft gebracht). Aan deze schade doet niet af dat andere zorgaanbieders hun patiënten (nog) hogere bedragen in rekening brengen voor een Invisalign-behandeling dan Beperfect heeft gedaan. Voorts is, zoals verzekeraars onweersproken stellen, ook aan de andere vereisten voor een vordering op grond van artikel 6:162 BW voldaan.
Verzekerden hebben hun vordering op Beperfect ter zake genoemde schade aan verzekeraars gecedeerd. Nu de rechtsgeldigheid van de door verzekeraars gestelde cessies door Beperfect niet langer wordt betwist, kan verder worden geoordeeld dat aan verzekeraars ter zake de schade een vorderingsrecht toekomt.
Niet-WMO-plichtig onderzoek: aantal artsen en patiënten beperkt
CGR Codecommissie geneesmiddelen 12 november 2012, Advies AA12.113 X heeft het voornemen een niet-WMO-plichtig onderzoek uit te voeren, getiteld “Z” en vraagt toetsing van dat voorgenomen onderzoek door de Commissie. Bij haar adviesaanvraag heeft zij documenten gevoegd. In relatie tot dit doel van het onderzoek is ook de betekenis van de doelen voor de voorschrijvende arts duidelijk en van belang voor de uitoefening van zijn praktijk. Nu het aantal artsen en patiënten dat deel zal nemen aan dit onderzoek is beperkt acht de Codecommissie daarin geen gevaar meer gelegen dat het onderzoek zal leiden tot irrationeel voorschrijfgedrag. Daar komt bij dat de vergoeding die de artsen voor hun bijdrage zullen ontvangen bescheiden van aard is. Hoewel dit niet aan een positief advies in de weg staat, blijft de vraag onbeantwoord waarom een specialist per patiënt ruim 2,5 maal het bedrag ontvangt dat aan een huisarts wordt toegekend. Uit het protocol blijkt niet dat de specialist op een andere wijze bij het onderzoek is betrokken dan een huisarts. Het oordeel is dus positief.
X heeft het voornemen een niet-WMO-plichtig onderzoek uit te voeren, getiteld “Z” en vraagt toetsing van dat voorgenomen onderzoek door de Commissie. Bij haar adviesaanvraag heeft zij documenten gevoegd. In relatie tot dit doel van het onderzoek is ook de betekenis van de doelen voor de voorschrijvende arts duidelijk en van belang voor de uitoefening van zijn praktijk. Nu het aantal artsen en patiënten dat deel zal nemen aan dit onderzoek is beperkt acht de Codecommissie daarin geen gevaar meer gelegen dat het onderzoek zal leiden tot irrationeel voorschrijfgedrag. Daar komt bij dat de vergoeding die de artsen voor hun bijdrage zullen ontvangen bescheiden van aard is. Hoewel dit niet aan een positief advies in de weg staat, blijft de vraag onbeantwoord waarom een specialist per patiënt ruim 2,5 maal het bedrag ontvangt dat aan een huisarts wordt toegekend. Uit het protocol blijkt niet dat de specialist op een andere wijze bij het onderzoek is betrokken dan een huisarts. Het oordeel is dus positief.
2.4 De Richtlijnen verlangen onder 3.c.i. duidelijkheid over het belang van het verkrijgen van resultaten uit een niet-WMO-plichtig onderzoek. In het herziene protocol met een andere primaire doelstelling komt naar het oordeel van de Commissie voldoende tot uitdrukking dat het onderzoek kan bijdragen aan de voor de voorschrijvende arts essentiële kennis over de effectiviteit van [medicijn C] voor de [ziekte B] controle van de patiënt in vergelijking tot die controle bij gebruik van een ander middel. In relatie tot dit primaire doel van het onderzoek is ook de betekenis van de secundaire doelen voor de voorschrijvende arts duidelijk en van belang voor de uitoefening van zijn praktijk. Nu het aantal artsen en patiënten dat deel zal nemen aan dit onderzoek is beperkt acht de Codecommissie daarin geen gevaar meer gelegen dat het onderzoek zal leiden tot irrationeel voorschrijfgedrag. Daar komt bij dat de vergoeding die de artsen voor hunbijdrage zullen ontvangen bescheiden van aard is. Hoewel dit niet aan een positiefUitgangspunt van de Richtlijnen is blijkens de toelichting daarop de erkenning dat registratie van het geneesmiddel niet het einde van de onderzoeks- en ontwikkelingsactiviteiten betreft, maar dat door verder onderzoek naar de werking van het geneesmiddel in de praktijk de fabrikant verbeteringen in de toepassing van het
geneesmiddel en de informatie daarover kan bevorderen. Een dergelijk onderzoek moet een wetenschappelijk doel hebben. Door de wijze waarop een dergelijk onderzoek wordt uitgevoerd en het betreffende geneesmiddel daardoor onder de aandacht van artsen wordt gebracht kan onder omstandigheden sprake zijn van reclame voor dat geneesmiddel. Blijkens de Gedragscode geneesmiddelen Reclame wordt immers onder reclame verstaan iedere aanprijzing van geneesmiddelen en daarmee samenhangende diensten of denkbeelden, daaronder begrepen het aanbieden of vragen van diensten of goederen in de omgang tussen vergunninghouders en beroepsbeoefenaren. Dergelijke onderzoeken zijn daarom slechts toelaatbaar indien de dienst die van de arts tegen beloning voor zijn
medewerking wordt gevraagd “van belang is voor de uitoefening van de geneeskunst, de farmacie, de tandheelkunst of de verloskunst” (art. 94 onder a Geneesmiddelenwet) en indien het betreffende onderzoek niet leidt tot ”irrationeel voorschrijfgedrag” (art. 5 onder b Uitwerking).2.4 De Richtlijnen verlangen onder 3.c.i. duidelijkheid over het belang van het verkrijgen van resultaten uit een niet-WMO-plichtig onderzoek. In het herziene protocol met een andere primaire doelstelling komt naar het oordeel van de Commissie voldoende tot uitdrukking dat het onderzoek kan bijdragen aan de voor de voorschrijvende arts essentiële kennis over de effectiviteit van [medicijn C] voor de [ziekte B] controle van
de patiënt in vergelijking tot die controle bij gebruik van een ander middel. In relatie tot dit primaire doel van het onderzoek is ook de betekenis van de secundaire doelen voor de voorschrijvende arts duidelijk en van belang voor de uitoefening van zijn praktijk. Nu het aantal artsen en patiënten dat deel zal nemen aan dit onderzoek is beperkt acht de Codecommissie daarin geen gevaar meer gelegen dat het onderzoek zal leiden tot irrationeel voorschrijfgedrag. Daar komt bij dat de vergoeding die de artsen voor hun bijdrage zullen ontvangen bescheiden van aard is. Hoewel dit niet aan een positief advies in de weg staat blijft de vraag onbeantwoord waarom een specialist per patiënt ruim 2,5 maal het bedrag ontvangt dat aan een huisarts wordt toegekend. Uit het protocol blijkt niet dat de specialist op een andere wijze bij het onderzoek is betrokken dan een huisarts.
2.5. De slotsom van het voorgaande is dat het door [X] voorgenomen niet-WMO-plichtig onderzoek thans voldoet aan de eisen die de Gedragscode Geneesmiddelenreclame en artikel 94 a Geneesmiddelenwet aan een dergelijk onderzoek stellen, zodat het advies positief kan zijn.De Codecommissie bepaalt dat de aan deze adviesaanvraag verbonden kosten aan verzoekster separaat in rekening zullen worden gebracht.Aldus gedaan te Amsterdam, 12 november 2012 door mr. J.A.J. Peeters, voorzitter.
The new Commission eHealth Action Plan, and some thoughts on what it will mean for devices

 Een bijdrage van Erik Vollebregt, Axon Lawyers.
Een bijdrage van Erik Vollebregt, Axon Lawyers.
Last week the Commission launched its new eHealth Plan (EHAP). It was announced under the header “Putting patients in the driving seat: A digital future for healthcare”. A nice rundown of the relevant documents is here and a good summary by MedTech Europe (Eucomed and EDMA) is here. Then there is the convenient overview and roadmap over here giving an overview of actions to be implemented in 2012 – 2020. You might want to take a look at this Commission presentation on eHealth of last month giving you the short and comprehensive version of what they then expected to be in EHAP.
These developments are important for the medical devices industry, for several reasons. First, more and more medical devices are standalone software and provides as service. Those are now explicitly regulated under the proposed Medical Devices Regulation and proposed In Vitro Diagnostic Devices Regulation. Secondly, more and more medical devices will connect to the internet as part of healthcare services in the internet of things. Thirdly, these devices, both software/service devices and physical ones, need degrees of interoperability to function together.
Lees verder hier















