Internetconsultatie Wet aanpassing innovatiebox

Internetconsultatie Wet aanpassing innovatiebox 19 mei tot 16 juni 2016.
De innovatiebox is een regeling in de Wet op de vennootschapsbelasting 1969 (Wet Vpb 1969) als gevolg waarvan materieel een lager belastingtarief geldt voor winsten die toerekenbaar zijn aan bepaalde innovaties. Deze regeling wordt aangepast vanwege in OESO-verband gemaakte afspraken over patentboxen. Met de consultatie wordt beoogd een reactie te krijgen op:
1) de bruikbaarheid van de systematiek zoals neergelegd in het ontwerp van het wetsvoorstel en
2) de signalering van mogelijke aanvullingen op en/of onjuistheden in het ontwerp van het wetsvoorstel.
Voedingsmiddelenreclame gericht op kinderen in Tsjakka jeugdmagazine

Vz. RCC 6 april 2016, dossiernr. 2016/00213 (jeugdmagazine Tsjakka)
Strijd met 11 NRC, RVV en KJC. Het betreft een advertentie voor ‘Koetjesreep’ in de editie 02-2016 van het jeugdmagazine ‘Tsjakka!’. Dit magazine wordt elke maand verspreid via leden van de Superunie (Plus, Coop, Spar, MCD Supermarkten, Poeisz Supermarkten, Hoogvliet, Jan Linders, Deka, Nettorama, Attent, Emté Supermarkten, Golff, Vomar, Sanders, Deen en Boni) en is ook online beschikbaar. De doelgroep van het magazine is personen tussen 8 en 14 jaar.
Uitspraak ingezonden door Sven Klos, Allard Ringnalda en Josine van den Berg, KLOS c.s..
Heksenkaas smeerdip doet zich niet misleidend voor als soort kaas

Rechtbank Rotterdam 13 mei 2016, IEF 15956; LS&R 1321; RB 2716 (Heksenkaas tegen Ministerie VWS)
Reclamerecht. Etikettering. In geschil is of met het merk Heksenkaas het Warenwetbesluit Etikettering van levensmiddelen is overtreden door de onjuiste indruk te wekken dat de smeerdip een soort kaas is en misleidend is ten aanzien van de samenstelling van het product. De ingrediëntenlijst vermeld niet dubbelzinnig en klip en klaar: smeerdip met 16% roomkaas en verse kruiden. Het bestreden besluit wordt herroepen.
Proefprocedure tegen huisarts over failliette declaratieservice

Rechtbank Amsterdam 11 mei 2016, LS&R 1320; ECLI:NL:RBAMS:2016:2736 (curator LHV Declaratie Direct tegen huisarts)
Proefprocedure. Tussen huisarts en door Landelijke Huisartsenvereniging opgerichte declaratieservice gesloten overeenkomst voor financiële dienstverlening waarbij gebruik wordt gemaakt van een stichting beheer derdengelden. Na faillissement van zowel de declaratieservice als de stichting beheer derdengelden, vordert de curator van de stichting het aan de huisarts teveel betaalde. De kern van het geschil is of de overeenkomst tussen de huisarts en de declaratieservice de grondslag kan zijn voor een vordering van de curator van de stichting en zo ja of aan de huisarts teveel is betaald en hoe de hoogte van een eventuele vordering dient te worden bepaald.
Doorbraak in discussie kwekers- en octrooirecht

De Europese Commissie wil via een nadere interpretatie van de biotech-richtlijn helderheid en rechtszekerheid bieden over het patenteren van natuurlijke eigenschappen op groenten en andere planten. Dat heeft Eurocommissaris Elzbieta Bienkowska (Interne Markt) gezegd op het door staatssecretaris Martijn van Dam (Economische Zaken, zijn speech) georganiseerde symposium ‘Finding the Balance’.
Artikel 843a Rv niet te gebruiken in procedure over voorlopig getuigenverhoor

Rechtbank Amsterdam 12 mei 2016, IEF 15951, IT 2062, RB 2715; LS&R 1318; ECLI:NL:RBAMS:2016:2759 (843a Rv en voorlopig getuigenverhoor)
Procesrecht. Geen IE-zaak. Een vordering ex art. 843a Rv kan niet worden ingediend in een verzoekschriftprocedure tot het houden van een voorlopig getuigenverhoor. Een verzoek tot het houden van een voorlopig getuigenverhoor wordt niet aangemerkt als een lopend geding: dit verzoek wordt immers juist ingediend om te bewerkstelligen dat getuigen worden gehoord voordat een geding aanhangig is of wordt gemaakt. De verwijzing van de Hoge Raad (ECLI:NL:HR:2000:AA4877) in r.o. 4.1.3 naar “eiser of verzoeker” ziet kennelijk op verzoekers in (andere) verzoekschriftprocedures die als “een lopend geding” kunnen worden aangemerkt en die in dat kader een verzoek op de voet van artikel 843a Rv hebben gedaan. Toepassing wisselbepaling van art. 69 Rv. Voorlopig getuigenverhoor toegewezen.
Eerst Centraal Tuchtcollege verzoeken om niet-reglementaire spoedprocedure

Vzr. Rechtbank Den Haag 13 april 2015, LS&R 1317; ECLI:NL:RBDHA:2016:5097 (Opheffing schorsing BIG-register)
Vordering tot opheffing schorsing van inschrijving in BIG-register. Het reglement van het Centraal Tuchtcollege voorziet niet expliciet in een spoedprocedure, maar de slotbepaling bepaalt dat het college beslist in gevallen waarin het reglement voorziet. Advocaat van eiser heeft zich telefonisch laten informeren over de gebruikelijke doorlooptijden, maar kennelijk niet om een voorlopige voorziening verzocht bij het Tuchtcollege. De beslissing wordt aangehouden tot eiser zich gemotiveerd en gedocumenteerd over deze mogelijkheden kan uitlaten.
IE-Forum.be-lunch: privacy, ecommerce en trade secrets

Sponsors 50% reductie! Op woensdag 18 mei 2016 van 12u00 - 15u15 organiseert deLex, de uitgever van IE-Forum.be, een intensieve actualiteitenlunch. Tijdens deze IE-Forum.be-lunchbijeenkomst bespreken Jos Dumortier, Bart Van den Brande en Gunther Meyer met u de belangrijkste Belgische en Europese ontwikkelingen op het gebied van het privacyrecht, e-commerce en trade secrets. De essentie en het belang voor de praktijk wordt besproken. In slechts drie uur tijd bent u volledig op de hoogte van de ontwikkelingen in de meest recente ontwikkelingen van het afgelopen (half) jaar. Aanmelden hier
Combinatiepreparaat voor verbeterde therapietrouw ligt voor de hand
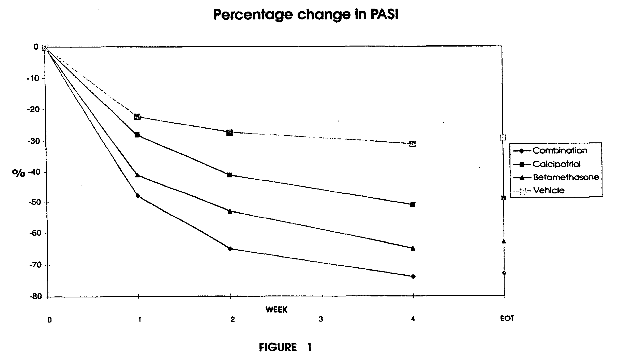
Vzr. Rechtbank Den Haag 11 mei 2016, IEF 15938; LS&R 1315; ECLI:NL:RBDHA:2016:5093 (Leo pharma tegen Sandoz)
Octrooirecht. Leo Pharma is houdster van EP 2 455 083 B1 getiteld “Pharmaceutical composition for dermal use comprising calcipotriol and betamethasone”; dit octrooi is verleend via een afgesplitste aanvrage. De therapietrouw zou worden verbeterd doordat er niet beurtelings een zalf in de morgen of avond ter behandeling van psoriasis wordt toegepast. Het synergetisch effect draagt bij aan het technisch effect. Het gebruik van twee producten in één zalf is voor de handliggend en niet inventief. Er is een combinatiepreparaat beschreven in voorbeeld 1 van WO 450. Er een gerede kans is dat de ingeroepen conclusies van het octrooi geen stand zullen houden.
Prejudiciële vragen HvJ EU over verboden transgene mais voor (dier)voeding

Prejudiciële vragen HvJ EU 10 december 2015, LS&R 1314; zaak C-111/16 (Fidenato)
Voedselveiligheid (genetisch gemodificeerde organismen). Verzoeker heeft van de rechter-commissaris een strafbeschikking ontvangen wegens het telen van transgene mais, hetgeen in ITA bij wet verboden. Verzoeker gaat in verzet stellende dat het onderliggend besluit onwettig is (genomen zonder inachtneming van de procedureregels van Vo. 178/2002, met name artikel 34). Verzoeker voert aan dat de ITA regering de EURCIE een aantal wetenschappelijke studies heeft voorgelegd en op grond van artikel 53/54 van Vo. 178/2002 op 11-04-2013 de EURCIE heeft verzocht om de noodmaatregelen van artikel 34 van Vo. 1829/2003 te treffen. De EURCIE antwoordde daarop (17-05-2013) dat zij daarin geen reden voor onderzoek zag maar de Europese Autoriteit voor Voedselveiligheid (EVVA) zou inschakelen en met verzoek voor eind september 2013 te rapporteren. Op grond van het advies van EVVA van 24-09-2013 (ITA levert geen nieuw wetenschappelijk bewijs die de noodmaatregelen onderbouwen) heeft de EURCIE de vergunning van Monsanto ongewijzigd gelaten. Desondanks heeft ITA voorlopige nationale maatregelen getroffen.















