Een octrooi en certificaat voor ieder van de beschermde producten
Rechtbank ´s-Gravenhage 12 oktober 2012, reg.nr. AWB 10/4769 (Georgetown University tegen NL Octrooicentrum)
.gif) Octrooirecht. ABC. Eén van kracht zijnd basisoctrooi dat meerdere producten beschermt, en dat aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten. Na de heropening IEF 11581, waar de rechtbank van oordeel was dat het onderzoek niet volledig is geweest en heropend dient te worden, nu een verwijzingsuitspraak waarin de rechtbank de volgende vijf vragen stelt.
Octrooirecht. ABC. Eén van kracht zijnd basisoctrooi dat meerdere producten beschermt, en dat aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten. Na de heropening IEF 11581, waar de rechtbank van oordeel was dat het onderzoek niet volledig is geweest en heropend dient te worden, nu een verwijzingsuitspraak waarin de rechtbank de volgende vijf vragen stelt.
Vraag 1 Verzet Verordening 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen, meer in het bijzonder artikel 3, aanhef en onder c daarvan, zich ertegen dat, in de situatie dat een van kracht zijnd basisoctrooi meerdere producten beschermt, aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten?
Vraag 2 Indien de eerste vraag bevestigend moet worden beantwoord, hoe dient artikel 3, aanhef en onder c, van de Verordening te worden uitgelegd in de situatie dat een van kracht zijnd basisoctrooi meerdere producten beschermt en op de aanvraagdatum van een certificaat voor één van de door het basisoctrooi beschermde producten (A), weliswaar nog geen certificaten waren verkregen voor andere producten (B, C) beschermd door hetzelfde basisoctrooi, doch op die aanvragen voor de producten (B, C) certificaten zijn afgegeven voordat op de aanvrage voor een certificaat voor het eerstgenoemde product (A) is beslist?
Vraag 3 Is het voor de beantwoording van de vorige vraag van belang of de aanvrage voor één van de door het basisoctrooi beschermde producten (A) op dezelfde datum is ingediend als de aanvragen voor andere producten (B, C) beschermd door hetzelfde basisoctrooi?
Vraag 4 Indien de eerste vraag bevestigend moet worden beantwoord, kan een certificaat worden afgegeven voor een door een van kracht zijnd basisoctrooi beschermd product, indien reeds eerder voor een ander door hetzelfde basisoctrooi beschermd product een certificaat is afgegeven, maar van dit laatste certificaat door de aanvrager afstand wordt gedaan met het oogmerk een nieuw certificaat te kunnen verkrijgen op basis van hetzelfde basisoctrooi?
Vraag 5 Indien het voor beantwoording van de vorige vraag relevant is of de afstand terugwerkende kracht heeft, wordt de vraag of afstand terugwerkende kracht heeft beheerst door artikel 14, aanhef en onder b, van de Verordening of door het nationale recht? Indien de vraag of afstand terugwerkende kracht heeft wordt beheerst door artikel 14, aanhef en onder b, van de Verordening, dient die bepaling zo te worden uitgelegd dat afstand terugwerkende kracht heeft?
 Prejudiciële vragen gesteld door High Court of Justice, Chancery Division, Patents Court, Engeland & Wales, Verenigd Koninkrijk.
Prejudiciële vragen gesteld door High Court of Justice, Chancery Division, Patents Court, Engeland & Wales, Verenigd Koninkrijk.  Cassatie. Ontvankelijkheid cassatieberoep. Geval waarin bijéén arrest in meerdere zaken tegelijk uitspraak is gedaan. Instellen van beroep bij één dagvaarding. De partijen procederen in deze zaak over de al-dan-niet nietigheid van het voor Nederland verleende deel van een Europees octrooi, EP 03.347.066, en een daarmee verbonden aanvullend beschermingscertificaat als bedoeld in art. 90 e.v. ROW 1995.
Cassatie. Ontvankelijkheid cassatieberoep. Geval waarin bijéén arrest in meerdere zaken tegelijk uitspraak is gedaan. Instellen van beroep bij één dagvaarding. De partijen procederen in deze zaak over de al-dan-niet nietigheid van het voor Nederland verleende deel van een Europees octrooi, EP 03.347.066, en een daarmee verbonden aanvullend beschermingscertificaat als bedoeld in art. 90 e.v. ROW 1995. Een bijdrage van John Allen, uit de
Een bijdrage van John Allen, uit de  In't kort: Aanvullend Beschermingscertificaat. Het
In't kort: Aanvullend Beschermingscertificaat. Het  Aanvullend Beschermingscertificaat (ABC). Voor het geval het vonnis in onderhavig kort geding niet wordt gewezen vóór 1 september 2012 en Teva niet toezegt af te zullen zien van verhandeling van geneesmiddelen die irbesartan en HCTZ omvatten voor de duur van deze procedure, vordert Sanofi bij dagvaarding – naast een inbreukverbod met nevenvorderingen met betrekking tot Aanvullend Beschermingscertificaat met het nummer 990006 (hierna: ABC) – dat de voorzieningenrechter bij provisioneel vonnis, uitvoerbaar bij voorraad, Pharmachemie, respectievelijk Teva Nederland, verbiedt [kort gezegd] betrokken te zijn bij in het verkeer brengen op last een dwangsom. Deze provisionele vordering wordt toegewezen. De beslissing over de proceskosten worden aangehouden.
Aanvullend Beschermingscertificaat (ABC). Voor het geval het vonnis in onderhavig kort geding niet wordt gewezen vóór 1 september 2012 en Teva niet toezegt af te zullen zien van verhandeling van geneesmiddelen die irbesartan en HCTZ omvatten voor de duur van deze procedure, vordert Sanofi bij dagvaarding – naast een inbreukverbod met nevenvorderingen met betrekking tot Aanvullend Beschermingscertificaat met het nummer 990006 (hierna: ABC) – dat de voorzieningenrechter bij provisioneel vonnis, uitvoerbaar bij voorraad, Pharmachemie, respectievelijk Teva Nederland, verbiedt [kort gezegd] betrokken te zijn bij in het verkeer brengen op last een dwangsom. Deze provisionele vordering wordt toegewezen. De beslissing over de proceskosten worden aangehouden. In navolging van
In navolging van  Prejudiciële vragen gesteld door Court of Appeal (Engeland & Wales).
Prejudiciële vragen gesteld door Court of Appeal (Engeland & Wales).
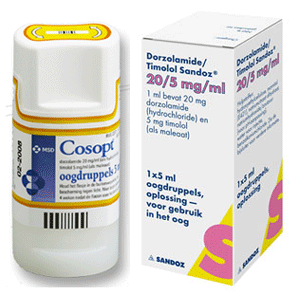 Uitspraak ingezonden door Klaas de Vries,
Uitspraak ingezonden door Klaas de Vries, 
















