Gynaecoloog heeft zich als chirurg gepresenteerd
Rechtbank Rotterdam 23 januari 2013, LJN BZ2397, BZ2365 (Borstoperatie door gynaecoloog)
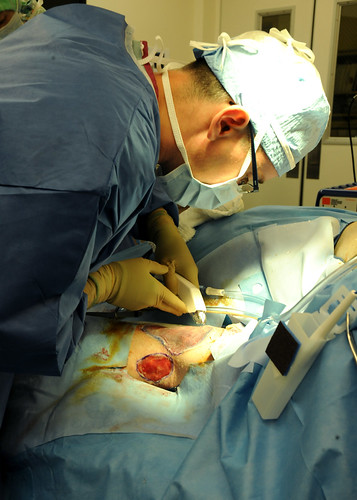 Eiseres heeft in een Belgische kliniek een borstoperatie laten uitvoeren door een in die kliniek werkzame Nederlandse arts. Vraag welk recht op het gestelde onrechtmatig handelen van toepassing is. Gedaagde heeft zich jegens eiseres als chirurg gepresenteerd terwijl hij in werkelijkheid gynaecoloog was. Door deze onjuiste indruk te wekken, heeft gedaagde in strijd gehandeld met de van een redelijk handelend en redelijk bekwaam arts te verwachten en te betrachten zorgvuldigheid. Gedaagde is aansprakelijk voor de schade die eiseres heeft geleden als gevolg van het feit dat zij door hem niet correct is geïnformeerd. Van belang hierbij is of voldoende aannemelijk is dat de gestelde klachten zich ook hadden voorgedaan in de hypothetische situatie dat zij zich door een plastisch chirurg hadden laten opereren. Deskundigenonderzoek.
Eiseres heeft in een Belgische kliniek een borstoperatie laten uitvoeren door een in die kliniek werkzame Nederlandse arts. Vraag welk recht op het gestelde onrechtmatig handelen van toepassing is. Gedaagde heeft zich jegens eiseres als chirurg gepresenteerd terwijl hij in werkelijkheid gynaecoloog was. Door deze onjuiste indruk te wekken, heeft gedaagde in strijd gehandeld met de van een redelijk handelend en redelijk bekwaam arts te verwachten en te betrachten zorgvuldigheid. Gedaagde is aansprakelijk voor de schade die eiseres heeft geleden als gevolg van het feit dat zij door hem niet correct is geïnformeerd. Van belang hierbij is of voldoende aannemelijk is dat de gestelde klachten zich ook hadden voorgedaan in de hypothetische situatie dat zij zich door een plastisch chirurg hadden laten opereren. Deskundigenonderzoek.
[gedaagde] heeft [eiser] niet juist geïnformeerd over de risico’s van een borstvergrotende operatie. Voorts heeft [gedaagde] de onjuiste indruk bij [eiser] gewekt dat hij een ervaren plastisch chirurg was. [eiser] heeft pas later vernomen dat [gedaagde] gynaecoloog is. Derhalve is [eiser] op dit punt door [gedaagde] misleid. Indien [eiser] had geweten dat [gedaagde] geen plastisch chirurg was, had zij zich niet door hem laten opereren. [gedaagde] heeft beide operaties uitgevoerd in een onvoldoende steriele/gereinigde ruimte en/of met onvoldoende steriel/gereinigde instrumenten waardoor na beide operaties een ernstige wondinfectie is opgetreden. Daarnaast heeft [gedaagde] een onjuiste behandelmethode toegepast en heeft hij na de tweede operatie onvoldoende nazorg betracht.
Indien wordt geoordeeld dat de behandelingsovereenkomst niet met [gedaagde] is gesloten, heeft [gedaagde], door aldus te handelen, onrechtmatig jegens [eiser] gehandeld.
De dientengevolge door [eiser] geleden en nog te lijden schade dient door [gedaagde] te worden vergoed.
3.3. [eiser] moet nog één hersteloperatie in het MCA ondergaan. Aangezien [eiser] de kosten van deze operatie niet kan betalen, is zij genoodzaakt een voorschot te vorderen op de in een schadestaat te begroten schade. Het voorschot van € 5.000,-- is als volgt opgebouwd:
- kosten hersteloperatie op 9 juni 2009 ad € 2.500,--;
- buitengerechtelijke kosten ad € 1.059,58;
- kosten opvragen medische informatie ad € 104,10;
- daggeldvergoeding ziekenhuisopname op 31 juli 2008 en 9 juni 2009 ad € 50,--;
- voorschot immateriële schade ad € 1.285,32.
4.2.4. Het vorenstaande in onderling verband en samenhang bezien, gaat de rechtbank er vanuit dat [gedaagde] geen partij is bij de met [eiser] gesloten behandelingsovereenkomst. Van enig toerekenbaar tekortschieten door [gedaagde] kan reeds daarom geen sprake zijn. Daarmee komt de rechtbank toe aan hetgeen [eiser] subsidiair aan haar vorderingen ten grondslag heeft gelegd, te weten onrechtmatig handelen van [gedaagde]. Alvorens daarop in te gaan, dient eerst het toe te passen recht te worden bepaald. Vaststaat immers dat [eiser] in een in België gevestigde kliniek is geopereerd door [gedaagde] die in die kliniek als Nederlandse arts werkzaam was. Derhalve is sprake van een internationaal kader.
4.3.3. De rechtbank is van oordeel dat in het onderhavige geval uit het geheel der omstandigheden kan worden afgeleid dat de gestelde onrechtmatige daad een (kennelijk) nauwere band heeft met België (Rome II) en tevens nauw verbonden is met de rechtsverhouding die voortvloeit uit de overeenkomst tussen [eiser] en de kliniek en in het verlengde daarvan, de rechtsverhouding van [eiser] met [gedaagde] (Wcod). De voorvallen (informatie, ingrepen, nazorg) die de onrechtmatige daad vormen zijn immers in België geschied, in een kliniek, voorzien van medicijnen, apparatuur, protocollen en personeel, die, bij gebreke van stellingen of feiten die op dit punt in een andere richting wijzen, naar mag worden aangenomen, conform de in België geldende regels wordt gedreven. De omstandigheid dat beide partijen in Nederland wonen is louter toeval. Niet gesteld of gebleken is dat [eiser] uitsluitend of zelfs maar bij voorkeur door een Nederlandse arts behandeld wenste te worden. Zoals hierna onder 4.5 en 4.11 aan de orde zal komen, wilde zij door een "goede chirurg" behandeld worden. [eiser] had dus evengoed door een Belgische arts of een arts van een andere nationaliteit geopereerd kunnen worden. De rechtbank is daarnaast van oordeel dat de gestelde onrechtmatige daad nauw verbonden is met de tussen de kliniek en [eiser] gesloten overeenkomst. Weliswaar betreft dit niet een reeds eerder bestaande overeenkomst tussen [eiser] en [gedaagde], maar dit gegeven ligt in dezelfde lijn als de, slechts bij wijze van voorbeeld, in de wet genoemde situatie dat een eerdere overeenkomst tussen partijen bestaat.
4.3.4. Gezien het vorenoverwogene is de rechtbank voornemens Belgisch recht op de gestelde onrechtmatige daad toe te passen.
4.11. [gedaagde] is jegens [eiser] aansprakelijk voor de schade die zij heeft geleden als gevolg van het feit dat zij door hem niet correct is geïnformeerd.
[eiser] heeft ter comparitie gesteld dat als zij van tevoren had geweten dat [gedaagde] geen (plastisch) chirurg was, zij de borstvergroting niet door hem had laten doen.
[gedaagde] heeft dit betwist en aangevoerd dat hij over de voor borstoperaties benodigde kwalificaties en ervaring beschikte.
De rechtbank acht aannemelijk dat [eiser] aan [gedaagde] geen toestemming voor de borstvergroting zou hebben gegeven indien hij haar correct zou hebben geïnformeerd over het feit dat hij geen (plastisch) chirurg maar gynaecoloog was. [eiser] heeft immers ter comparitie gesteld dat zij voor [gedaagde] had gekozen omdat hij volgens de informatie van de website van de kliniek een goede chirurg zou zijn en zij alleen "de beste" wilde. Gelet hierop acht de rechtbank het onwaarschijnlijk dat [eiser] ook toestemming voor de borstoperatie zou hebben verleend indien [gedaagde] haar correct omtrent zijn kwalificaties zou hebben geïnformeerd. Het had dan ook op de weg van [gedaagde] gelegen concrete feiten en omstandigheden aan te voeren waaruit kan worden afgeleid dat [eiser] niettemin toestemming voor de borstvergroting zou hebben verleend indien hij haar juist had geïnformeerd. Nu dergelijke feiten of omstandigheden niet door [gedaagde] zijn gesteld, komt de rechtbank aan bewijsvoering op dit punt niet toe.
4.14. De rechtbank stelt voorop dat het enkele feit dat bij [eiser] na de borstoperaties complicaties zijn opgetreden, niet meebrengt dat sprake is of moet zijn geweest van (tijdens en/of na die operaties) medisch onzorgvuldig handelen.
Om te kunnen beoordelen of [eiser] schade heeft geleden doordat zij niet correct door [gedaagde] is geïnformeerd omtrent zijn kwalificaties, is van belang of voldoende aannemelijk is dat de door [eiser] gestelde klachten/complicaties zich ook hadden voorgedaan in de (hypothetische) situatie dat zij zich door een plastisch chirurg had laten opereren. Daarbij zij opgemerkt dat de verschillen tussen de werkelijke en de hypothetische situatie niet alleen de persoon van de behandelend arts en zijn specialisme betreffen, maar ook andere omstandigheden die van grote invloed kunnen zijn op de aan een dergelijke behandeling verbonden risico's; bijvoorbeeld de (kwaliteit van de) operatieruimte, de operatietechniek, de bij de behandeling gebruikte apparatuur en de gebruikte implantaten. De rechtbank zal dan ook deze aspecten samen met het zich ten onrechte als chirurg voordoen beschouwen in het kader van de gestelde onrechtmatige daad.
4.15. Indien aannemelijk is dat ter zake van de door [gedaagde] uitgevoerde operaties complicaties zijn opgetreden die ook zouden zijn opgetreden indien [eiser] zich door een plastisch chirurg had laten opereren, ontbreekt het causale verband tussen het feit dat [gedaagde] [eiser] niet correct omtrent zijn kwalificatie heeft geïnformeerd en de gestelde schade.
Indien aannemelijk is dat de bij [eiser] opgetreden complicaties zich niet zouden hebben voorgedaan indien zij zich onder behandeling van een plastisch chirurg had gesteld, is sprake geweest van medisch onzorgvuldig handelen en dient de daaruit voortvloeiende schade door [gedaagde] te worden vergoed.
4.16. Aangezien uit de door partijen overgelegde (medische) informatie niet kan worden afgeleid of de complicaties die zich bij [eiser] hebben gerealiseerd zich ook in de (hypothetische) situatie waarin zij zich onder behandeling van een plastisch chirurg had gesteld, zouden hebben gerealiseerd, behoeft de rechtbank voorlichting door een onafhankelijk deskundige op dit punt. De rechtbank zal partijen in de gelegenheid stellen met elkaar in overleg te treden opdat zij vervolgens bij akte een – zoveel mogelijk eenparig – voorstel voor de modaliteiten (gegevens deskundige, vraagstelling en kosten) van het te gelasten deskundigenonderzoek kunnen doen. Ongeacht of Belgisch dan wel Nederlands recht op het gestelde onrechtmatig handelen van toepassing is, ligt het in de rede dat ter zake door een Belgische deskundige wordt geadviseerd. Immers, gezien het feit dat de behandelingen bij [eiser] in een Belgische kliniek zijn uitgevoerd, is relevant of die behandelingen conform de in België geldende regelgeving zijn uitgevoerd.
4.17. De rechtbank denkt voorlopig aan de volgende vraagstelling:
1. Kunt u een beschrijving geven van de tijdens of na de operatie op 30 april 2007 bij [eiser] opgetreden complicaties? Kunt u daarbij ingaan op de vraag of tijdens of na die operatie een infectie of ontsteking is ontstaan?
2. Heeft de betrokken arts naar uw oordeel de betreffende behandeling uitgevoerd in een voldoende steriele/gereinigde ruimte en/of met voldoende steriele/gereinigde instrumenten?
3. Waardoor zijn naar uw oordeel de complicaties bij [eiser] veroorzaakt? Kunt u aangeven of en zo ja in hoeverre de oorzaak van het ontstaan van die complicaties volgens u (mede) is toe te schrijven aan:
- de door de betrokken arts gehanteerde transareolaire incisietechniek;
- de (wijze van gebruik van de) toegepaste dual plane techniek.
4. Indien uw antwoord op vraag 2 ontkennend luidt, zijn naar uw oordeel (mede) als gevolg van het feit dat de betrokken arts de behandeling heeft uitgevoerd in een onvoldoende steriele/gereinigde ruimte en/of met onvoldoende steriele/gereinigde instrumenten complicaties bij [eiser] opgetreden, en zo ja, welke?
5. Indien naar uw oordeel tijdens of na de operatie op 30 april 2007 bij [eiser] een infectie of ontsteking is opgetreden en uw antwoord op vraag 2 ontkennend luidt, in hoeverre is die infectie of ontsteking dan (mede) toe te schrijven aan het feit dat de betrokken arts de behandeling heeft uitgevoerd in een onvoldoende steriele/gereinigde ruimte en/of met onvoldoende steriele/gereinigde instrumenten?
6. Bestond er op enig moment in de periode na 30 april 2007 in verband met de door [eiser] gemelde klachten en/of de ontwikkeling van de wond een indicatie voor nader onderzoek en/of behandeling anders of frequenter dan hetgeen feitelijk is uitgevoerd? Zo ja, welk onderzoek en/of behandeling, en op welk moment en op welke medische gronden bestond die indicatie?
7. Was de behandeling van [eiser] tijdens de operatie van 14 april 2008 geïndiceerd? Is die behandeling uitgevoerd zoals die – gezien de toenmalige opvattingen binnen uw beroepsgroep ten aanzien van de te hanteren professionele standaard bij deze behandeling en de door u gevonden oorza(a)k(en) (vraag 3, 4 en 5) – behoorde te worden uitgevoerd?
8. Kunt u een beschrijving geven van de tijdens of na de operatie op 14 april 2008 bij [eiser] opgetreden complicaties? Kunt u daarbij aandacht besteden aan de vraag of tijdens of na die operatie een infectie of ontsteking is opgetreden?
9. Heeft de betrokken arts naar uw oordeel de behandeling op 14 april 2008 uitgevoerd in een voldoende steriele/gereinigde ruimte en/of met voldoende steriele/gereinigde instrumenten?
10. Waardoor zijn naar uw oordeel de complicaties bij [eiser] veroorzaakt? Wilt u aangeven of en zo ja in hoeverre de oorzaak van het ontstaan van die complicaties volgens u (mede) is toe te schrijven aan de door de betrokken arts gehanteerde transareolaire incisie- en operatietechniek?
11. Indien uw antwoord op vraag 9 ontkennend luidt, zijn naar uw oordeel (mede) als gevolg daarvan complicaties bij [eiser] opgetreden en zo ja, welke?
12. Indien naar uw oordeel tijdens of na de operatie op 14 april 2008 bij [eiser] een infectie of ontsteking is opgetreden en uw antwoord op vraag 9 ontkennend luidt, is die infectie of ontsteking dan (mede) toe te schrijven aan het feit dat de betrokken arts de behandeling heeft uitgevoerd in een onvoldoende steriele/gereinigde ruimte en/of met onvoldoende steriele/gereinigde instrumenten?
13. Kunt u op grond van uw onderzoeksbevindingen en de overige beschikbare gegevens zo uitgebreid mogelijk en gemotiveerd aangeven of en zo ja welke van de bij [eiser] opgetreden complicaties naar uw mening op enig moment ook zouden zijn ontstaan bij een behandeling door een plastisch chirurg? Kunt u daarbij een indicatie geven op welke termijn en in welke mate dit dan het geval zou zijn geweest?
14. Is naar uw oordeel sprake geweest van medisch onzorgvuldig handelen?
15. Heeft u eventueel nog opmerkingen die anderszins voor de beoordeling van deze casus van belang kunnen zijn?
Stemmingen over de moties betreft geneesmiddelen
Stemmingen Geneesmiddelen, Handelingen II 2012/13, vergaderingnummer 38, 70. Aan de orde zijn de stemmingen over moties, ingediend bij het debat over geneesmiddelen, te weten:
Aan de orde zijn de stemmingen over moties, ingediend bij het debat over geneesmiddelen, te weten:
- de motie-Van Gerven over niet vergoeden van de NOACS (29477, nr. 213); motie wordt verworpen
- de motie-Van Gerven over voorzieningen voor acute farmaceutische zorg (29477, nr. 214); motie wordt verworpen
- de motie-Van Gerven over uitbreiding van de capaciteit van het CVZ (29477, nr. 215); motie wordt verworpen
- de motie-Voortman over financiële arrangementen (29477, nr. 216);
- de motie-Pia Dijkstra c.s. over het openbaar maken van de prijslijsten (29477, nr. 217); wordt verworpen.
- de motie-Pia Dijkstra over wetgeving voor uniforme barcodering voor geneesmiddelen en medische hulpmiddelen (29477, nr. 218); de motie wordt aangehouden.
Kamerbrief over Fiche Commissievoorstel eHealth
Kamerbrief Fiche 1: Mededeling eHealth Actie Plan 2012-2020, Innovatieve gezondheidszorg voor de 21e eeuw, kenmerk 22112, nr. 1565 De essentie van het voorstel heeft betrekking op eHealth. Onder eHealth wordt verstaan het toepassen van informatie- en communicatietechnologie (ICT) ten dienste van de gezondheidszorg. (...) Het gebruik van ICT in de gezondheidszorg kan bijdragen aan het verhogen van de efficiency, het verbeteren van de kwaliteit van leven en het ontsluiten van innovaties in de zorg. (...) Het actieplan kondigt verschillende activiteiten aan die zijn verdeeld over deze vier doelstellingen:
De essentie van het voorstel heeft betrekking op eHealth. Onder eHealth wordt verstaan het toepassen van informatie- en communicatietechnologie (ICT) ten dienste van de gezondheidszorg. (...) Het gebruik van ICT in de gezondheidszorg kan bijdragen aan het verhogen van de efficiency, het verbeteren van de kwaliteit van leven en het ontsluiten van innovaties in de zorg. (...) Het actieplan kondigt verschillende activiteiten aan die zijn verdeeld over deze vier doelstellingen:
- Bereiken van verdere interoperabiliteit van eHealth toepassingen;
- Ondersteunen van onderzoek, ontwikkeling en innovatie in eHealth om de beschikbaarheid van gebruiksvriendelijke toepassingen en diensten te vergroten;
- Verder opschalen van gebruikte toepassingen;
- Stimuleren van de publieke dialoog en internationale samenwerking ten aanzien van eHealth.
3. Wat is de Nederlandse grondhouding ten aanzien van de bevoegdheidsvaststelling, subsidiariteit en proportionaliteit van deze mededeling en de eventueel daarin aangekondigde concrete wet- en regelgeving? Hoe schat Nederland de financiële gevolgen in, alsmede de gevolgen op het gebied van regeldruk en administratieve lasten?
Bevoegdheidsvaststelling
De mededeling raakt aan veel beleidsterreinen waarvoor de EU gedeelde en aanvullende bevoegdheden heeft, zoals de interne markt, Trans-Europese Netwerken en gezondheidszorg.
Subsidiariteit
Gezien het grensoverschrijdende karakter van eHealth zoals de mogelijkheid van een beeldverbinding tussen patiënt en arts in verschillende lidstaten, en de wens om op Europees niveau een betere elektronische uitwisseling van medische gegevens mogelijk te maken, beoordeelt Nederland de subsidiariteit van de activiteiten.
Proportionaliteit
De door de Commissie genoemde maatregelen worden door Nederland over het algemeen als waardevol en proportioneel gezien. De meerwaarde van de Commissie ligt hierbij in het bundelen en de uitwisseling van kennis, het ondersteunen en delen van best practices en het stimuleren van het benutten van Europese instrumenten.
Financiële gevolgen
De aangekondigde activiteiten zijn nog niet in voldoende mate uitgewerkt om de financiële gevolgen goed te kunnen overzien. Daarom zal er bij de nadere uitwerking van de activiteiten per geval bekeken worden wat de financiële gevolgen zijn. De Commissie stelt voor om ondermeer gebruik te maken van CEF- en EFRO-middelen.
Vaststellen criteria bij aanbestedingsprocedure hulpmiddelen
Rechtbank Rotterdam 31 januari 2013, LJN BZ1903 en LJN BZ1895 (Vegro Verpleegartikelen B.V. en Welzorg tegen Gemeente Capelle aan den IJssel)
 |
 |
 |
Vegro vordert de gemeente te gebieden de aanbestedingsprocedure zodanig te wijzigen dat niet de eis wordt gesteld dat de inschrijver voldoet aan een gemiddelde liquiditeit van 1,00 over de laatste drie afgesloten boekjaren, omdat liquiditeit van 0,50 voldoende is. De vordering wordt afgewezen. Aangenomen moet worden dat de door de gemeente gehanteerde current ratio van 1,00 (nog) binnen de bandbreedte valt van wat gebruikelijk is bij deze aanbestedingen. Uit de toetsing is gebleken dat Vegro niet voldoet aan de selectiecriteria.
Het hanteren van objectieve criteria en eisen zoals voorgeschreven door de wet en de aanbestedingsrechtelijke beginselen, brengt mee dat een leverancier mogelijk wel capabel is om de opdracht uit te voeren, doch niet voldoet aan een formeel criterium en om die reden niet voor gunning in aanmerking komt. De gemeente zou het gelijkheidsbeginsel schenden indien zij de current ratio van 0,96 naar boven zou afronden. De gemeente heeft discretionaire bevoegdheid ten aanzien van de eisen aan financiële en economische draagkracht. De gestelde eisen moeten wel in redelijke verhouding staan tot de aard en de omvang van de opdracht.
Anders dan een liquiditeitseis, kan het overleggen van een VOG verklaring in een aanbesteding als de onderhavige niet als een van de belangrijke voorwaarden van de opdracht worden beschouwd, waarop belanghebbende marktdeelnemers zich hebben gebaseerd bij hun beslissing om een offerte voor te bereiden dan wel om van deelneming aan de aanbesteding af te zien.
De vordering van Welzorg, de gemeente te gebieden de inschrijving van Welzorg uit te sluiten in verband met stijd met aanbestedingsdocument en de daarin opgenomen regels en instructies, wordt afgewezen. Gebleken is dat door Welzorg geoffreerde kortingspercentages realistisch, aannemelijk en marktconform zijn. Welzorg heeft een deugdelijke verklaring gegeven over de wijze van totstandkoming van de door haar geoffreerde kortingspercentages, zodat er geen op algemene beginselen van aanbestedingsrecht gebaseerde reden is om ter zake een onderzoeksplicht van de gemeenten aan te nemen.
Het voorgaande brengt mee dat de vorderingen van Vegro jegens de gemeente zullen worden afgewezen en de eerste vordering van Welzorg jegens Vegro als na te melden zal worden toegewezen.
4.3. Dat de accountant de current ratio van 0,96 naar boven heeft afgerond omdat volgens hem de liquiditeitspositie van Vegro een gezonde ontwikkeling laat zien, maakt dit oordeel niet anders. Het hanteren van objectieve criteria en eisen zoals voorgeschreven door de wet en de aanbestedingsrechtelijke beginselen, brengt nu eenmaal mee dat een leverancier mogelijk wel capabel is om de opdracht uit te voeren, doch niet voldoet aan een formeel criterium en om die reden niet voor gunning in aanmerking komt. Het aanbestedingsdocument biedt voor een dergelijke afronding evenmin mogelijkheid en gesteld noch gebleken is dat voornoemde, duidelijk gedefinieerde eis ruimte laat voor de normaal behoorlijk geïnformeerde en normaal oplettende inschrijver om deze in die zin te begrijpen of interpreteren dat afronding wel is toegestaan, ook niet bij een minimale afwijking. Zou de gemeente ten aanzien van de inschrijving van Vegro wel toestaan de current ratio van 0,96 naar boven af te ronden, dan zou zij het gelijkheidsbeginsel schenden.
4.6. De voorzieningenrechter stelt voorop dat de aanbestedende dienst bij het stellen van eisen aan financiële en economische draagkracht ruime discretionaire bevoegdheid toekomt. De aanbestedende dienst dient na te gaan welke daadwerkelijke risico’s er zijn en of die risico’s worden afgedekt door de eisen die worden gesteld. De door de aanbestedende dienst gestelde eisen moeten wel in redelijke verhouding staan tot de aard en de omvang van de opdracht. De voorzieningenrechter kan dit slechts beperkt toetsen.
4.7. De stelling van [eiseres] dat de gemeenten de inschrijving van Welzorg met betrekking tot de geoffreerde kortingspercentages nader hadden moeten controleren wordt verworpen. De gemeenten mogen vertrouwen op de juistheid van hetgeen Welzorg heeft verklaard. Nu Welzorg bovendien een deugdelijke verklaring heeft gegeven over de wijze van totstandkoming van de door haar geoffreerde kortingspercentages, is er geen op algemene beginselen van aanbestedingsrecht gebaseerde reden om terzake een onderzoeksplicht van de gemeenten aan te nemen.
Bezwaar tegen handelsvergunningen vanwege onvoldoende vaststaan van bio-equivalentie
ABRvS 20 februari 2013, LJN BZ1668 (College ter Beoordeling van Geneesmiddelen en Novartis Pharma B.V. tegen uitspraak van de rechtbank Arnhem)
Handelsvergunningen. Biologische equivalentie. Ciclosporine.
2. Novartis is (...) gerechtigd om het ciclosporine bevattende geneesmiddel Neoral in Nederland in de handel te brengen. Ciclosporine bevattende geneesmiddelen worden onder meer toegepast bij patiënten die een orgaantransplantatie hebben ondergaan om afstoting van het getransplanteerde orgaan te voorkomen. Actavis, Pharmachemie en Heumann hebben het CBG verzocht om eveneens ciclosporine bevattende geneesmiddelen in Nederland in de handel te mogen brengen.
Bij onderscheiden besluiten van 5 en 11 april 2007 heeft het CBG de in die besluiten vermelde ciclosporine bevattende geneesmiddelen van Actavis Group hf., Pharmachemie B.V. en Heumann Pharma GmbH ingeschreven in het register als bedoeld in artikel 3 van de tot 1 juli 2007 geldende Wet op de geneesmiddelenvoorziening. Deze inschrijvingen zijn ingevolge artikel 117, vijfde lid, van de Geneesmiddelenwet per 1 juli 2007 gelijkgesteld met handelsvergunningen als bedoeld in die wet.
3. Novartis heeft tegen de verlening van de handelsvergunningen aan Actavis, Pharmachemie en Heumann bezwaar gemaakt, omdat volgens haar de biologische equivalentie (hierna: bio-equivalentie) van hun geneesmiddelen met het referentiegeneesmiddel Neoral niet genoegzaam is aangetoond en derhalve niet vaststaat dat die geneesmiddelen generiek zijn aan Neoral. Bio-equivalentie houdt in dat de biologische beschikbaarheid van geneesmiddelen, dat wil zeggen de mate en snelheid waarmee de werkzame stoffen uit de farmaceutische vorm vrijkomen, in het bloed worden opgenomen en beschikbaar worden op de plaats waar hun voornaamste werkzaamheid op is gericht, gelijk is. (...)
4. De rechtbank heeft - kort samengevat - overwogen dat het besluit (...) voor zover daarbij de aan Heumann verleende handelsvergunningen zijn gehandhaafd, onvoldoende zorgvuldig is voorbereid en daardoor ondeugdelijk is gemotiveerd. Voor zover dat besluit betrekking heeft op de aan Actavis en Pharmachemie verleende handelsvergunningen kan het naar het oordeel van de rechtbank in rechte stand houden.
Het hoger beroep van het CBG richt zich tegen het eerste oordeel van de rechtbank, het hoger beroep van Novartis tegen het tweede.
De handelsvergunningen van Heumann
6.1 (...) CBG heeft terecht betoogt dat de rechtbank in strijd met artikel 8:69, eerste lid, van de Awb buiten de grenzen van het aan haar voorgelegde geschil is getreden door een oordeel te geven over de farmaceutische vorm van het geneesmiddel van Heumann en het referentiegeneesmiddel. Dit leidt echter niet tot een vernietiging van de aangevallen uitspraak om die reden, aangezien het CBG het oordeel van de rechtbank over de bio-equivalentie in hoger beroep niet heeft bestreden en dat oordeel de gegrondverklaring van het beroep en de vernietiging van het besluit (...), voor zover dat ziet op de aan Heumann verleende handelsvergunningen, zelfstandig kan dragen.De handelsvergunningen van Actavis en Pharmachemie
8.3 Met de rechtbank is de Afdeling van oordeel dat het CBG (...) zich in redelijkheid op het standpunt heeft kunnen stellen dat het eisen van nadere bio-equivalentiestudies uitgevoerd onder niet-nuchtere omstandigheden niet nodig was om te beoordelen of erkenning van de in Ierland verleende handelsvergunningen een mogelijk ernstig risico voor de volksgezondheid zou kunnen vormen. Er bestaat derhalve geen grond voor het oordeel dat uit het advies van het CHMP en het besluit van de Europese Commissie moet worden afgeleid dat de besluitvorming van het CBG over Actavis en Pharmachemie onzorgvuldig is geweest.
De Afdeling bestuursrechtspraak van de Raad van State bevestigt de aangevallen uitspraak en verklaart het beroep van Novartis Pharma B.V. tegen het met een besluit gelijk te stellen niet tijdig nemen van een besluit gegrond.
Onethisch zakendoen en de overtreding van interne gedragscode
 Als randvermelding. Arbeidsrecht. Handelen in strijd met gedragscode(s). Verandering in omstandigheden. Arbeidsovereenkomst wordt ontbonden. Onethisch handelen.
Als randvermelding. Arbeidsrecht. Handelen in strijd met gedragscode(s). Verandering in omstandigheden. Arbeidsovereenkomst wordt ontbonden. Onethisch handelen.
Medtronic ontwikkelt medische hulpmiddelen en implantaten voor humaan gebruik in verschillende medische domeinen. Verweerder was werkzaam in de functie van Interim Business Manager Spine voor België. Vanwege een vermoeden van misstanden (zaken doen op onethische wijze) is een intern onderzoek is gestart. Aan het verzoek van Medtronic, tot ontbinding van de arbeidsovereenkomst met verweerder heeft zij ten grondslag gelegd dat er sprake is van een dringende reden of verandering in de omstandigheden, op grond waarvan de arbeidsovereenkomst moet worden ontbonden.
Binnen Medtronic gelden interne gedragsregels met daarin normen voor zakelijk gedrag. Vaststaat dat verweerder regels heeft overtreden. Door op onethische wijze uitvoering te geven aan de trainingscontracten heeft hij gehandeld in strijd met de interne gedragsregels en mogelijk ook in strijd met wetgeving. Beoordeeld moet worden of dit een dringende reden voor ontbinding van de arbeidsovereenkomst oplevert. Daarvoor is naar het oordeel van de kantonrechter van belang of sprake is van verwijtbaar c.q. laakbaar handelen van een individuele werknemer. De kantonrechter is van oordeel dat niet is komen vast te staan dat er sprake is van een dringende reden voor ontbinding.
Nu het vorenstaande niet tot een ontbinding van de arbeidsovereenkomst wegens een dringende reden kan leiden, dient beoordeeld te worden of er zich feiten en omstandigheden hebben voorgedaan die een ontbinding wegens een verandering in de omstandigheden rechtvaardigen. De aard van de overtreding, de verantwoordelijke positie van verweerder, de voorbeeldfunctie van een dergelijke functionaris, het gegeven dat verweerder (direct) profiteerde van de verhoogde omzet en het feit dat verweerder door de diverse trainingen goed op de hoogte was van de interne en externe gedragsregels, leiden tot het oordeel dat ontbinding van de arbeidsovereenkomst is gerechtvaardigd. Niet duidelijk is of sprake is van onethisch handelen, deze onduidelijkheid komt voor rekening van de werkgever en vormt aanleiding om aan de ontbinding een vergoeding te verbinden ten laste van werkgever.
3.7 Beoordeeld moet worden of het vorenstaande een dringende reden voor ontbinding van de arbeidsovereenkomst oplevert. Daarvoor is naar het oordeel van de kantonrechter van belang of in onderhavige casus sprake is van verwijtbaar c.q. laakbaar handelen van een individuele werknemer of van een (deel van de) organisatie? Slechts indien er alleen sprake is van laakbaar handelen door [verweerder], levert dit, in de specifieke relatie tussen een werknemer en een werkgever, een dringende reden voor ontbinding op. (...) Het is daardoor voor de kantonrechter niet mogelijk om op basis van die onderzoeksresultaten zich een oordeel te vormen over de omvang van de door Medtronic gestelde verwijtbare gedragingen en de personen die daarbij direct of indirect waren betrokken, of betrokken zijn geweest. Dat dient voor rekening en risico van Medtronicte komen. De overige verklaringen waar door Medtronic naar is verwezen, zijn door [verweerder] gemotiveerd betwist. Ook op basis van de door [verweerder] in het geding gebrachte producties kan - mede vanwege de gemotiveerde betwisting door Medtronic - niet worden vastgesteld dat er sprake was van een wijdverbreid handelen binnen Medtronic in strijd met de gedragsregels.
3.9 Om te bepalen of aan de uit te spreken ontbinding een vergoeding moet worden verbonden, is onder meer van belang om vast te stellen in wiens risicosfeer de ontbindingsgrond valt en of de (aanleiding tot de) verstoorde arbeidsverhouding in overwegende mate aan één van de partijen is te wijten. Voorop staat dat [verweerder] binnen het bedrijf geldende gedragsregels heeft overtreden. Daarvan kan hem een verwijt worden gemaakt. In beginsel dient dit te betekenen dat voor het toekennen van een vergoeding bij de ontbinding geen plaats is. Medtronic heeft het doen voorkomen alsof het alleen [verweerder] was die de gedragsregels heeft geschonden en dat er geen sprake was van een ‘common practice’ van onethisch handelen binnen het bedrijf. Zoals hiervoor onder 3.7 is overwogen, is het echter niet mogelijk om te oordelen of dat inderdaad het geval was, terwijl dit mogelijk anders zou zijn geweest als Medtronic de resultaten van haar interne onderzoek wel in het geding had gebracht. De kantonrechter kan dan ook niet uitsluiten dat er binnen Medtronic wel sprake is geweest van het op grotere/grote schaal onethisch handelen ter zake de trainingscontracten. Naar het oordeel van de kantonrechter dient deze omstandigheid een corrigerende invloed te hebben op een al of niet toe te kennen vergoeding, nu deze onduidelijkheid voor rekening van Medtronic komt. Om die reden ziet de kantonrechter in het onderhavige geval aanleiding om aan de ontbinding een vergoeding te verbinden ten laste van Medtronic.
Ruim 3500 geneesmiddelen zonder handelsvergunning
Rechtbank 's-Gravenhage 8 november 2012, LJN BY3412 (Kamagra zonder handelsvergunning)
Verdachte heeft (...) ruim 3500 geneesmiddelen (Kamagra) in voorraad gehad terwijl hij daar geen handelsvergunning voor had. Verdachte heeft louter uit persoonlijk gewin gehandeld en het gebruik van geneesmiddelen waarvoor geen vergunning is afgegeven kan fatale gevolgen hebben. Gevangenisstraf van 4 weken met aftrek.
6.3. (...) Voorts heeft verdachte ruim 3500 geneesmiddelen in voorraad gehad, terwijl hij daar geen handelsvergunning voor had. Het ongecontroleerd in voorraad hebben van dergelijke geneesmiddelen vormt een ernstige bedreiging voor de volksgezondheid. Het gebruik van geneesmiddelen waarvoor geen vergunning is afgegeven kan fatale gevolgen hebben.
De op te leggen straf is gegrond op de artikelen:
- 45, 57, 310 en 311 van het Wetboek van Strafrecht;
- 40 van de Geneesmiddelenwet;
- 1, 2 en 6 van de Wet op de Economische Delicten.De rechtbank, (...) verklaart wettig en overtuigend bewezen, dat de verdachte de bij dagvaarding onder 3 en 5 tenlastegelegde feiten heeft begaan en dat het bewezenverklaarde uitmaakt:
ten aanzien van feit 5: overtreding van een voorschrift gesteld bij artikel 40, tweede lid, van de Geneesmiddelenwet, opzettelijk begaan
Informatieplicht weegt in deze zwaarder dan onderzoeksplicht
Rechtbank Oost-Nederland, locatie Enschede 18 februari 2013, LJN BZ1359 (Stichting Livio tegen verweerder) In navolging van LS&R 438. Voorwaardelijke ontbinding. Vertrouwensbreuk. Informatieplicht tijdens sollicitatie. Geen vergoeding.
In navolging van LS&R 438. Voorwaardelijke ontbinding. Vertrouwensbreuk. Informatieplicht tijdens sollicitatie. Geen vergoeding.
Werknemer, arts, heeft bij sollicitatie naar functie verpleeghuisarts (i.o.) geen melding gemaakt van zijn strafrechtelijke verleden wegens een levensdelict en de in het kader van de strafzaak vastgestelde persoonlijkheidsstoornis. Verweerder heeft omstreeks juli 2003 twee junks bereid gevonden om, tegen betaling, zijn ex-echtgenote in brand te steken. In verband daarmee is verweerder veroordeeld tot een gevangenisstraf van 15 jaar voor een poging tot moord op zijn ex-echtgenote. In het kader van de strafzaak heeft een persoonlijkheidsonderzoek plaatsgevonden en is gebleken dat verweerder (op dat moment) leed aan een persoonlijkheidsstoornis en is hij verminderd toerekeningsvatbaar geacht.
Sollicitant dient informatie waarvan hij behoort te weten dat die voor de werkgever in verband met een eventueel te sluiten arbeidsovereenkomst van belang kan zijn, te melden. Strafrechtelijk verleden wordt in beginsel beschermd door 8 EVRM, maar in dit geval had werknemer - gelet op beoogde functie, arts voor een groep kwetsbare ouderen, zijn verleden - tijdens zijn sollicitatie en zeker ook nadien toen hij door werkgever met vragen werd geconfronteerd, werkgever dienen te informeren.
De oorzaak te komen tot ontbinding wegens een vertrouwensbreuk ligt in overwegende mate in de risicosfeer van verweerder. Werkgever had er goed aan gedaan zelf verder onderzoek te doen en bijvoorbeeld Verklaring Omtrent Gedrag te vragen, maar de informatieplicht weegt in deze zwaarder dan de onderzoeksplicht, temeer nu werknemer tijdens de sollicitatie en daarna werkgever door onvolledige informatie ‘op het verkeerde been‘ heeft gezet. De kantonrechter ontbindt, indien niet reeds van rechtswege, de tussen partijen bestaande arbeidsovereenkomst voorwaardelijk met ingang van 1 maart 2013.
“Swedish Document” reloaded – a new boost for medical devices standalone software regulation
 |
 |
Sweden is a lovely and industrious country that takes engineering very seriously; the small Scandinavian country that we know from its boxy but good cars also builds its own fighter jets (pretty good ones actually) and is determined to put its mark on the regulation of standalone software under EU medical devices law. The Swedish competent authority Läkemedelsverket has now issued a new version of the famous Swedish Document with the obvious agenda to influence guidance on standalone software under EU medical devices law in the way it has done before with MEDDEV 2.1/6.
Let’s take a look at the document, keeping in mind that the Swedish authorities tend to want to interpret the scope of ‘medical device’ with regard to standalone software wider than most EU countries. An indication of this is that on p. 17 it is stated that
“It is important to bear in mind that it is both the functionality of a product as well as the intended purpose stated by the manufacturer that determines whether software is qualified as a medical device.”
This is in contradiction with the case law of the European Court of Justice, which recently ruled in the Brain Products case that the intended purpose assigned to a device by the manufacturer determines its status as medical device, and not its functionality. Although the court was not as clear as it could have been – as I have argued – it held that using functionality as a deciding criterion would lead to regulation as medical devices of many devices that could be used as a medical device but are intended for other purposes, so this is the wrong way to interpret the concept of ‘medical device’.
This agenda of Swedish Authorities is pretty transparent when the report goes on to say that
“However, there are information systems for the health care sector where the manufacturer has not defined their device as a medical device, but still it could affect the safety for patients under certain conditions. Health care providers should in these instances still consider if those systems should be handled with the same awareness of safety as if it had been a medical device.”
and
“On the Swedish market most RIS are for instance CE marked as medical devices.”
In other words, we would actually like to regulate software of which the use in clinical settings could carry risk for patients, even though the report itself says that risk as such can never be a deciding criterion (p. 13). The report also doesn’t mention that the Swedish market is pretty unique in this respect and that this perspective is not shared by most other national authorities in the EU. I have it on good authority that there was also controversy about this between the member states when they were discussing the text for MEDDEV 2.1/6. Just so you know that this is clearly one view at one end of the regulatory spectrum.
As with the initial version the report provides a lot of useful detail and examples. Compared to the existing EU MEDDEV the report contains useful guidance on
- software as service (para 4.1.5), clarifying that this can of course also be a medical device;
- smartphone apps (para 4.1.6), clarifying that an app that qualifies as medical devices does not necessarily makes the phone as such or the combination of the two a medical device; and
- ‘home brew’ standalone software (para. 4.3), clarifying that one should approach this along the lines of the thinking surrounding home brew IVDs.
The appendix to the document is well worth reading and contains several separate annexes on interesting subjects with a lot of practical information and guidelines:
Annex 1. Risk management
Annex 2. Standards and recent development of standards
Annex 3. Clinical evaluation of medical information systems
Annex 4. Networks
Annex 5. Procurement and issues referring to CE marking (most interesting for me personally, as it discusses tendering strategy for software systems)
Annex 6. Product examples (the largest part of the document, with 19 case studies of software examples. Exercise with caution however, as the Swedish authorities tend to draw the scope of the concept ‘medical device’ wider than others).
All in all a very worthwhile read indeed and guaranteed to provoke discussion in the process surrounding the revision of the standalone software MEDDEV 2.1/6. Also, the annexes provide useful practical examples for the growing apps and other software industry about how conformity assessment for a software medical device works.
However, I think the report could have done better at discussion of the concept of accessory. The report stops at the statement that “[s]tandalone software can, without having a medical purpose of its own, be essential to maintain an intended function of another medical device. It can then be an accessory to a medical device.” This is not a very precise statement at all. I, personally, think that the definition of accessory is extremely important, as the discussion of several examples of modular systems in the report shows when it discusses how non-medical modules can still be regulated as accessories to the medical device module. I think it is even more crucial to develop a position on the concept of accessory in view of the considerable extension in scope in the current proposal for the new regulation on medical devices and the proposal for a new regulation for IVDs to include devices that not only “enable” but also “assist” a medical device in achieving its intended purpose. The definition of this humble little concept will have a severe impact on regulation of standalone software in networks and systems, and, consequently, all eHealth, telemedicine and mHealth services that rely on networks and systems.
Erik Vollebregt
Peer-reviewproject verlangt van advocaten om geheimhoudingsplicht te schenden
Hof Arnhem-Leeuwarden, locatie Arnhem 12 februari 2013, LJN BZ0644 (Piketadvocaten tegen De Raad voor Rechtsbijstand)
 Verwerking van persoonsgegevens. Geheimhoudingsplichten. Onrechtmatig handelen.
Verwerking van persoonsgegevens. Geheimhoudingsplichten. Onrechtmatig handelen.
De zaak gaat over de vraag in hoeverre de Raad onrechtmatig handelt jegens de Piketadvocaten door van hen te verlangen om mee te werken aan het zogenaamde peer-reviewsysteem. Daarmee beoogt de Raad een kwaliteitsoordeel te verkrijgen over de gefinancierde rechtsbijstand, die de Piketadvocaten verlenen aan personen die op grond van de Wet bijzondere opnemingen in psychiatrische ziekenhuizen gedwongen worden opgenomen in psychiatrische ziekenhuizen.
De Piketadvocaten hebben in het onderhavige kort geding gesteld dat de Raad onrechtmatig jegens de Piketadvocaten handelt door het peer-reviewsysteem in te voeren. De Raad verlangt namelijk van de Piketadvocaten om hun cliëntdossiers over te leggen, terwijl zij als advocaat en tevens uit hoofde van de medische aard van de in die dossiers opgenomen gegevens, verplicht zijn tot geheimhouding daarvan. Het hof is voorts van oordeel dat de door de Raad voorziene peer-reviewprocedure, waarin is voorzien in de afgifte en doorzending van kopiedossiers, valt onder de definitie van verwerking van persoonsgegevens, gegeven in artikel 1 onder b. Wbp.
Het feit dat de secretaris en de Peer eveneens verplicht zijn tot geheimhouding neemt niet weg dat door de toezending aan hen van de kopiedossiers waarin (medische en andere) persoonsgegevens zijn opgenomen, de kring van personen die van die gegevens kennis dragen groter wordt, zodat het daarbij gaat om verspreiding van de gegevens. Het hof concludeert dat de Raad in het kader van het peer-reviewsysteem van de Piketadvocaten verlangt om geheimhoudingsplichten te schenden en dat dit onrechtmatig is. Het hof vernietigt het vonnis van de voorzieningenrechter en ontslaat de Piketadvocaten uit de verplichting om deel te nemen aan het peer-reviewproject.
4.17. Uit de in artikel 1 onder a. en onder c. Wbp gegeven definities blijkt dat de cliëntendossiers, die de Raad wil laten inzien door de Peers, telkens aangemerkt moeten worden als onderdeel van een bestand in de zin van de Wbp. In elk van die dossiers bevindt zich namelijk een geheel van gegevens betreffende een geïdentifi¬ceerde of, na volledige anonimisering: identificeerbare natuurlijke persoon (de cliënt), zodat het daarbij om “persoonsgegevens” gaat. Het dossier maakt op zijn beurt deel uit van de verzameling van cliëntdossiers, die de betrokken advocaat heeft aangelegd en die in praktijk als één geheel wordt beschouwd en die, zoals de Raad ook niet heeft betwist, plegen te zijn gestructureerd en volgens bepaalde criteria toegankelijk zijn. Naar het oordeel van het hof is de Wbp daarom van toepassing op de door de Raad voorziene toezending van (geanonimiseerde) cliëntendossiers aan de secretaris van de CPR en aan de Peers.
4.21. Het feit dat de secretaris en de Peer eveneens verplicht zijn tot geheimhou¬ding neemt niet weg dat door de toezending aan hen van de kopiedossiers waarin (medische en andere) persoonsgegevens zijn opgenomen, de kring van personen die van die gegevens kennis dragen groter wordt, zodat het daarbij gaat om verspreiding van de gegevens. Hetzelfde geldt voor het feit dat de dossiers binnen korte tijd moeten worden vernietigd: de persoonsgegevens zijn dan reeds verspreid.
4.23. Op grond van het vorenstaande moet voorshands geconcludeerd worden dat de Raad in het kader van het Peer Reviewsysteem van de Piketadvocaten verlangt om geheimhoudingsplichten te schenden en dat dit onrechtmatig is. Het gevorderde verbod kan echter slechts tussen de Piketadvocaten en de Raad gelden, aangezien anderen dan partijen in de procedure aan de uitspraak geen rechten kunnen ontlenen. Dit leidt tot gedeeltelijke afwijzing van de vordering.
















