HvJ EU 7 maart 2013, Zaak C-358/11 (Lapin ELY-keskus, liikenne ja infrastruktuuri) - dossier
 Prejudiciële vragen gesteld door Korkein hallinto-oikeus, Finland.
Prejudiciële vragen gesteld door Korkein hallinto-oikeus, Finland.
In steekwoorden: Milieu – Afvalstoffen – Gevaarlijke afvalstoffen – Richtlijn 2008/98/EG – Voormalige telefoonpalen die met CCA-oplossingen (koper-chroom-arseen) zijn behandeld – Registratie, beoordeling en autorisatie van chemische stoffen – Verordening nr. 1907/2006 (REACH-verordening) – Overzicht in bijlage XVII bij REACH-verordening van toepassingen van behandeld hout – Voormalige telefoonpalen die als structuur voor smalle bruggen zijn gebruikt
Het Hof (Vierde kamer) verklaart voor recht:
1) Het Unierecht sluit in beginsel niet uit dat een als gevaarlijk aangemerkte afvalstof niet langer een afvalstof is in de zin van richtlijn 2008/98/EG van het Europees Parlement en de Raad van 19 november 2008 betreffende afvalstoffen en tot intrekking van een aantal richtlijnen, wanneer zij door middel van een behandeling voor nuttige toepassing bruikbaar kan worden gemaakt zonder dat dit gevaar oplevert voor de menselijke gezondheid en nadelige gevolgen heeft voor het milieu, en voorts niet wordt geconstateerd dat de houder van het betrokken voorwerp zich ervan ontdoet dan wel voornemens of verplicht is zich ervan te ontdoen in de zin van artikel 3, punt 1, van die richtlijn, hetgeen de verwijzende rechter dient na te gaan.
2) Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad van 18 december 2006 inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH), tot oprichting van een Europees Agentschap voor chemische stoffen, houdende wijziging van richtlijn 1999/45/EG en houdende intrekking van verordening (EEG) nr. 793/93 van de Raad en verordening (EG) nr. 1488/94 van de Commissie alsmede richtlijn 76/769/EEG van de Raad en de richtlijnen 91/155/EEG, 93/67/EEG, 93/105/EG en 2000/21/EG van de Commissie, zoals gewijzigd bij verordening (EG) nr. 552/2009 van de Commissie van 22 juni 2009, met name bijlage XVII erbij, moet, voor zover zij het gebruik van met een zogenaamde „CCA”-oplossing (koper-chroom-arseen) behandeld hout onder bepaalde voorwaarden toestaat, aldus worden uitgelegd dat zij in omstandigheden als die van het hoofdgeding relevant is om te bepalen of dergelijk hout mogelijkerwijs niet langer een afvalstof is omdat de houder ervan, wanneer aan die voorwaarden is voldaan, niet is gehouden zich ervan te ontdoen in de zin van artikel 3, punt 1, van richtlijn 2008/98.
3) De artikelen 67 en 128 van verordening nr. 1907/2006, zoals gewijzigd bij verordening nr. 552/2009, moeten aldus worden uitgelegd dat het Unierecht een harmonisatie tot stand brengt van de voorwaarden inzake de vervaardiging, het in de handel brengen of het gebruik van stoffen zoals arseenverbindingen, waarvoor overeenkomstig bijlage XVII bij deze verordening een beperking geldt.
4) Nr. 19, punt 4, sub b, van bijlage XVII bij verordening nr. 1907/2006, zoals gewijzigd bij verordening nr. 552/2009, waarin is opgesomd voor welke toepassingen met een zogenaamde „CCA”-oplossing (koper-chroom-arseen) behandeld hout bij wijze van uitzondering kan worden gebruikt, moet aldus worden uitgelegd dat de in die bepaling opgenomen opsomming een limitatief karakter heeft en dat deze uitzondering bijgevolg niet kan worden toegepast op andere dan de daarin genoemde gevallen. Het staat aan de verwijzende rechter om na te gaan of het gebruik van de litigieuze telefoonpalen ter ondersteuning van smalle bruggen in omstandigheden als die van het hoofdgeding wel degelijk onder de in die bepaling opgesomde toepassingen valt.
5) Nr. 19, punt 4, sub d, tweede streepje, van bijlage XVII bij verordening nr. 1907/2006, zoals gewijzigd bij verordening nr. 552/2009, volgens hetwelk met een zogenaamde „CCA”-oplossing (koper-chroom-arseen) behandeld hout niet mag worden gebruikt voor toepassingen waarbij gevaar voor herhaald huidcontact bestaat, moet aldus worden uitgelegd dat het betrokken verbod geldt voor alle situaties waarin de huid naar alle waarschijnlijkheid herhaaldelijk met het behandelde hout in aanraking komt. Het staat aan de verwijzende rechter om op basis van de concrete omstandigheden van het normale gebruik van de toepassing waarvoor dat hout is gebruikt, te beoordelen of van een dergelijke waarschijnlijkheid sprake is.
Gestelde vragen:
1. Kan uit de omstandigheid dat afval als gevaarlijk afval is ingedeeld, rechtstreeks worden geconcludeerd dat het gebruik van de stof of het voorwerp over het geheel genomen ongunstige effecten heeft voor het milieu of de menselijke gezondheid in de zin van artikel 6, punt 1, sub d, van richtlijn 2008/98/EG1 van het Europees Parlement en de Raad betreffende afvalstoffen en tot intrekking van een aantal richtlijnen? Vormt ook gevaarlijk afval niet langer afval, wanneer is voldaan aan de in artikel 6, punt 1, van richtlijn 2008/98 vastgestelde voorwaarden?
2. Moet bij de uitlegging van het begrip afval en bij de beoordeling van de verplichting om zich van een stof of voorwerp te ontdoen, belang worden gehecht aan de omstandigheid dat hergebruik van het te beoordelen voorwerp volgens de in artikel 67 van de REACH-verordening2 genoemde bijlage XVII onder bepaalde voorwaarden is toegestaan? Zo ja, welk belang moet aan deze omstandigheid worden gehecht?
3. Zijn door artikel 67 van de REACH-verordening de voorschriften voor de vervaardiging, het in de handel brengen of het gebruik in de zin van artikel 128, lid 2, van de REACH-verordening geharmoniseerd, zodat het gebruik van de in bijlage XVII genoemde preparaten en voorwerpen niet kan worden belet op basis van nationale bepalingen betreffende de bescherming van het milieu, als deze beperkingen niet zijn gepubliceerd in het door de Commissie opgestelde overzicht, bedoeld in artikel 67, lid 3, van de REACH-verordening?
4. Moet de in nr. 19, punt 4, sub b, van bijlage XVII bij de REACH-verordening opgenomen opsomming van toepassingen van met CCA geïmpregneerd hout aldus worden uitgelegd dat daarin alle mogelijke toepassingen zijn opgenomen?
5. Kan de onderhavige toepassing als grond- en draagbalken voor een houtpad gelijk worden gesteld met de toepassingen die zijn opgenomen in de in vraag 4 genoemde opsomming, zodat deze toepassing op basis van nr. 19, punt 4, sub b, van bijlage XVII bij de REACH-verordening kan worden toegestaan wanneer aan de overige noodzakelijke voorwaarden is voldaan?
6. Welke factoren moeten in aanmerking worden genomen om te bepalen of er een gevaar van herhaald huidcontact bestaat in de zin van nr. 19, punt 4, sub d, van bijlage XVII bij de REACH-verordening?
7. Wordt in nr. 19, punt 4, sub d, van bijlage XVII bij de REACH-verordening met de uitdrukking "gevaar [...] bestaat" bedoeld dat herhaald huidcontact theoretisch mogelijk is, of wordt ermee bedoelt dat dit contact ten minste in zekere beperkte mate waarschijnlijk is?
 Contra-analyse, verboden stof in urinemonsters, verzoek toegewezen in verband met contra-analyse. Verweerder besluit tot uit de handel nemen en vernietigen van alle runderen van verzoekster op de stallijst. Verzoekster voert onder meer aan dat niet vaststaat dat de helft of meer van de genomen monsters positief is. Verzoekster stelt dat de monsters van het dode dier niet meegerekend mogen worden in de steekproef. Voorts blijkt uit de contra-analyse van [naam 5] B.V. dat slechts acht (en dus minder dan de helft) van de monsters positief zijn getest. Voorzieningenrechter wijst het verzoek toe en schorst besluit van uit de handel nemen en vernietigen van de runderen.
Contra-analyse, verboden stof in urinemonsters, verzoek toegewezen in verband met contra-analyse. Verweerder besluit tot uit de handel nemen en vernietigen van alle runderen van verzoekster op de stallijst. Verzoekster voert onder meer aan dat niet vaststaat dat de helft of meer van de genomen monsters positief is. Verzoekster stelt dat de monsters van het dode dier niet meegerekend mogen worden in de steekproef. Voorts blijkt uit de contra-analyse van [naam 5] B.V. dat slechts acht (en dus minder dan de helft) van de monsters positief zijn getest. Voorzieningenrechter wijst het verzoek toe en schorst besluit van uit de handel nemen en vernietigen van de runderen. Uitlegging van verordening (EEG) nr. 2658/87. Indeling van een stof die de selectieve fluorescente detectie mogelijk maakt van biomoleculen in biologische of biomedische toepassingen. Het Hof verklaart voor recht: de gecombineerde nomenclatuur die is opgenomen in bijlage I bij verordening (EEG) nr. 2658/87, moet aldus worden uitgelegd dat een uit oplosmiddelen en een polymethinesubstantie samengesteld product dat textiel weliswaar lichtjes en kortstondig kan kleuren, maar in feite niet wordt gebruikt voor zijn kleurend vermogen en uitsluitend bedoeld is om witte bloedcellen te analyseren aan de hand van de ionenbinding die zich voordoet met bepaalde bestanddelen van deze bloedcellen, die bij bestraling met laserlicht tijdelijk een fluorescerende werking krijgen, valt onder post 3822 van deze gecombineerde nomenclatuur, die betrekking heeft op reageermiddelen voor laboratoriumgebruik.
Uitlegging van verordening (EEG) nr. 2658/87. Indeling van een stof die de selectieve fluorescente detectie mogelijk maakt van biomoleculen in biologische of biomedische toepassingen. Het Hof verklaart voor recht: de gecombineerde nomenclatuur die is opgenomen in bijlage I bij verordening (EEG) nr. 2658/87, moet aldus worden uitgelegd dat een uit oplosmiddelen en een polymethinesubstantie samengesteld product dat textiel weliswaar lichtjes en kortstondig kan kleuren, maar in feite niet wordt gebruikt voor zijn kleurend vermogen en uitsluitend bedoeld is om witte bloedcellen te analyseren aan de hand van de ionenbinding die zich voordoet met bepaalde bestanddelen van deze bloedcellen, die bij bestraling met laserlicht tijdelijk een fluorescerende werking krijgen, valt onder post 3822 van deze gecombineerde nomenclatuur, die betrekking heeft op reageermiddelen voor laboratoriumgebruik.) Verzoek om een prejudiciële beslissing [
Verzoek om een prejudiciële beslissing [ Prejudiciële vragen gesteld door High Court of Justice, Chancery Division, Patents Court (Verenigd Koninkrijk). Zie eerder
Prejudiciële vragen gesteld door High Court of Justice, Chancery Division, Patents Court (Verenigd Koninkrijk). Zie eerder  Met samenvatting van
Met samenvatting van 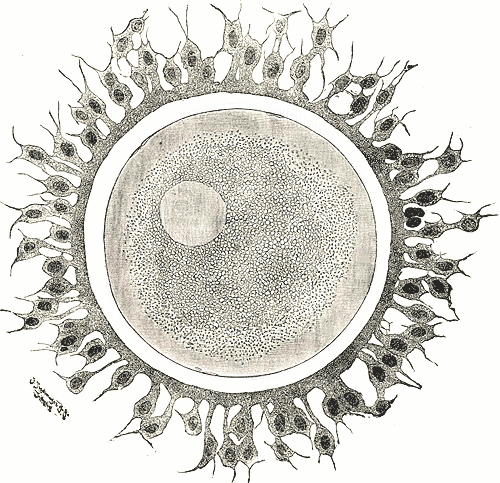 Octrooirecht. Biotechnologische uitvinding. Er wordt voortgebouwd op de Brüstle-vragen/beslissing [
Octrooirecht. Biotechnologische uitvinding. Er wordt voortgebouwd op de Brüstle-vragen/beslissing [ Hogere voorziening ingesteld tegen de beschikking van het Gerecht (Zevende kamer) van 21 september 2011, PPG en SNF / ECHA (
Hogere voorziening ingesteld tegen de beschikking van het Gerecht (Zevende kamer) van 21 september 2011, PPG en SNF / ECHA ( Prejudiciële vragen gesteld door het Bundespatentgericht, Duitsland.
Prejudiciële vragen gesteld door het Bundespatentgericht, Duitsland.

















